Als Medizintechnik versteht man eine Untermenge der Medizinprodukte, die auch als Medizingeräte bezeichnet wird. Gleichzeitig bildet die Medizintechnik eine organisatorische Einheit in Krankenhäusern.
Inhalt
Diese Seite verschafft Herstellern und Betreibern von Medizintechnik bzw. Medizingeräten einen schnellen Überblick über die
- Medizintechnik / Medizingeräte selbst,
- regulatorischen Anforderungen an die Medizintechnik und
- Unterstützung beim Einhalten dieser Anforderungen.
1. Überblick über die Medizintechnik / Medizingeräte
a) Begriffe und Taxonomie
Der Begriff Medizinprodukt stellt den Überbegriff für viele Produktkategorien dar. Man unterscheidet beispielsweise:
- Aktive und nicht aktive Medizinprodukte: Aktive Medizinprodukte sind solche, die eine Energieversorgung haben, in der Regel in Form eines Netzanschlusses oder einer Batterie bzw. eines Akkus.
- Medizinprodukte mit und ohne Messfunktion: Auch bei Produkten mit Messfunktion müssen die Hersteller bei der Konformitätsbewertung eine Benannte Stelle einbeziehen.
Unter Medizingeräten versteht man meist „physische“ programmierbare elektrische medizinische Systeme (PEMS), also aktive Medizinprodukte. Standalone-Software wird nicht als Medizingerät klassifiziert.
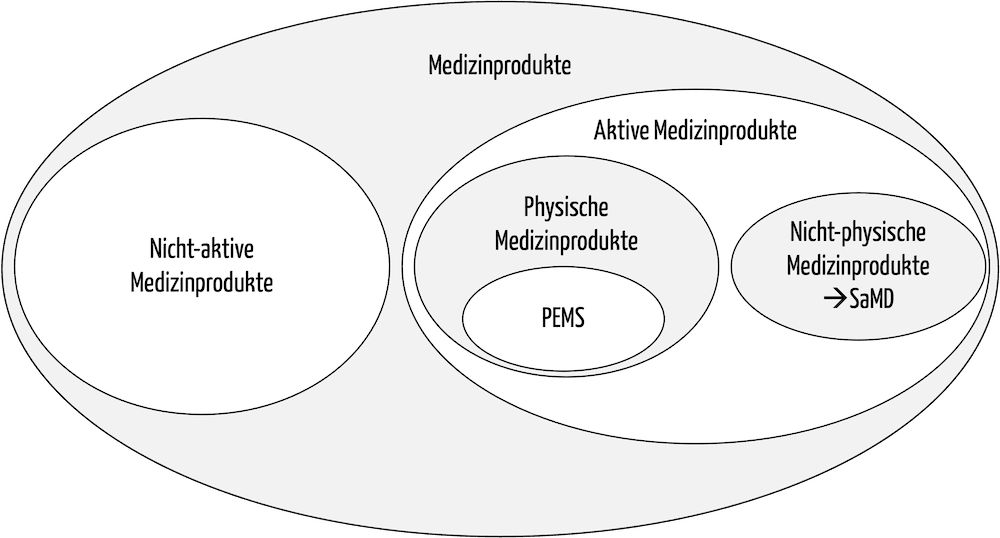
Abb. 1: In der Taxonomie der Medizinprodukte entsprechen die Medizingeräte physischen aktiven Medizinprodukten, insbesondere programmierbare elektrische medizinische Systeme (PEMS).
Der Begriff Medizintechnik wird manchmal synonym mit dem Begriff Medizingeräte genutzt. Manchmal meint man damit die Abteilung im Krankenhaus, die für die Medizingeräte zuständig ist.
Häufig gibt es Probleme mit der Zuordnung klinischer Informationssysteme. Diese sind oft Medizinprodukte, zählen aber nicht zur klassischen Medizintechnik.
b) Bedeutung der Medizintechnik
Die Medizintechnik ist ein bedeutender Wirtschaftsfaktor. Aktuelle Zahlen liefert beispielsweise BVMed.
Ein Fachartikel beleuchtet die Trends in der Medizintechnik. Zu diesen zählen Entwicklung und Einsatz von autonomen Systemen und Closed-Loop-Systemen.
2. Regulatorische Anforderungen an Medizingeräte
a) Anforderungen an die Hersteller
Da Medizingeräte eine Teilmenge der Medizinprodukte sind, gelten alle regulatorischen Anforderungen an Medizinprodukte auch für die Medizingeräte.
Weiterführende Informationen
Die Seite Regulatory Affairs listet alle Gesetze, Normen, Verordnungen und Leitlinien auf. In Europa sind besonders die MDR und das MPDG zu beachten.
Neben den grundlegenden Sicherheits- und Leistungsanforderungen sollten die Hersteller die Anforderungen an medizinisch-elektrische Geräte und die IEC 60601-Familie beachten. Dazu zählen neben den Anforderungen an die elektrische Sicherheit auch Anforderungen an die Interoperabilität, die wesentlichen Leistungsmerkmale und die funktionale Sicherheit.
b) Anforderungen an die Betreiber
Die Betreiber von Medizingeräten bzw. Medizintechnik unterliegen ebenfalls gesetzlichen Anforderungen, beispielsweise der MPBetreibV.
Eine Übersicht enthält der Schlagwortbeitrag zu den Krankenhäusern, Laboren und anderen Betreibern. Dieser verweist auf die Vorgaben zur Installation, Wartung und Außerbetriebnahme von Medizinprodukten. Er geht auch auf bestimmte Produkttypen ein, z. B. Kombinationen von Medizinprodukten, Produkte mit Mehrfachsteckdosen und Medizinprodukte-PCs.
Unterstützung
Haben Sie noch Fragen zur Entwicklung oder zum Betrieb von Medizingeräten? Qualifizierte und zudem kostenlose Antworten erhalten Sie im Micro-Consulting.
Melden Sie sich gleich, wenn Sie Unterstützung wünschen, um Ihre Medizingeräte schnell und sicher zu entwickeln und zuzulassen.
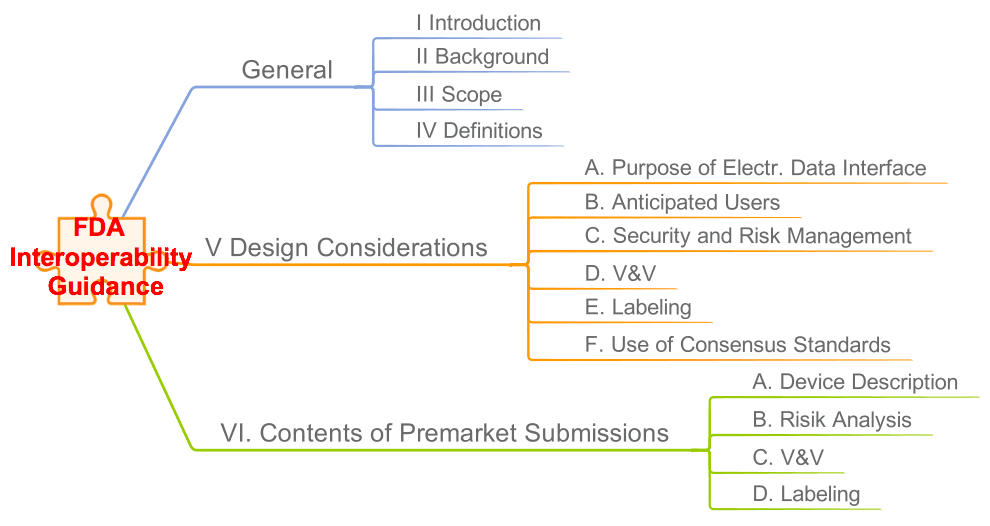
Die FDA hat ein Interoperability Guidance als Entwurf veröffentlicht. Es trägt den Titel „Design Considerations and Pre-market Submission Recommendations for Interoperable Medical Devices“ (hier zum Download). Lesen Sie hier, was die FDA damit bezweckt und auf welche Anforderungen Sie sich einstellen müssen.
Details
Die IEC 60601-1 definiert ein PESS, ein programmierbares elektronisches Subsystem, als System, das auf einer oder mehreren zentralen Prozessoreinheiten beruht, einschließlich deren Software und Schnittstellen. Die Norm verrät nicht, was sie unter System versteht, es ist in diesem Kontext eine Komponente des Medizinprodukts. Dafür stellt die IEC 60601-1 konkrete Anforderungen an die PESS.
Details
Medizingeräte verfügen über zahlreiche Hardware-Schnittstellen. Diese sollten Hersteller genau dokumentieren, um das Produkt ohne unnötige Nachbesserungen entwickeln, Testfälle ableiten und regulatorische Forderungen erfüllen zu können. Dieser Beitrag gibt Tipps, wie es Ihnen gelingen wird, die Hardware-Schnittstellen Ihrer Medizinprodukte schnell und präzise zu spezifizieren.
Details
Projektmanager benötigt und hat fast jedes Unternehmen. Auch die Hersteller von Medizinprodukten und klinischen Informationssystemen. Doch was unterscheidet das Projektmanagement in der Medizintechnik von anderen Branchen? Was muss ein Projektmanager in der Medizintechnik zusätzlich können?
„Wie schreibt man erstfehlersichere Software?“ lautet die Frage, die mir eine Teilnehmerin meines Seminars medizinische Software stellt. Eine exzellente Frage, die ich nicht in einem Satz beantworte möchte: