Viele regulatorische Vorgaben fordern die Hersteller auf, Prozesse und Verfahren festzulegen. Solche Forderungen stellen beispielsweise die EU-Verordnungen (MDR und IVDR), Normen wie die ISO 13485, IEC 62304 und ISO 14971 sowie die FDA.
Inhalt
Sie finden auf dieser Seite Verweise auf Fachartikel zu Prozessen und Verfahren:
- Artikel zu Prozessen und Verfahren im Allgemeinen
- Artikel zu einzelnen Prozessen und Verfahren
- Hinweise zur Unterstützung bei Prozessen und Verfahren
1. Artikel zu Prozessen und Verfahren im Allgemeinen
a) Abgrenzung von Prozessanweisungen und Verfahrensanweisungen
Die Beschreibung von Prozessen und Verfahren unterscheidet sich in ihrem Granularitätsgrad. Prozesse beschreiben, WAS gemacht wird. Verfahrensanweisungen beschreiben, WIE etwas gemacht wird.
Aber die regulatorischen Anforderungen unterscheiden beides nicht immer präzise.
Alle Anweisungen müssen letztlich bestimmen,
- wer wann was in welcher Reihenfolge auf welche Weise macht
- und dabei welchen Input in welchen Output überführt.
b) Artikel
Die Prozesse und Verfahren sind Teil des Qualitätsmanagements. Diese Übersichtseite verschafft einen guten Einstieg in das Thema Qualitätsmanagement.
Hilfreich sind die Artikel zum Erstellen von Prozess- und Verfahrensanweisungen sowie zum risikobasierten Ansatz bei Prozessen. Das Schreiben dieser Vorgabedokumente sollte nur bei ausgewählten Prozessen die Aufgabe des QM-Beauftragten sein.
Sind die Prozesse definiert, müssen sie einer Prozessvalidierung unterworfen werden.
Hersteller sollten den Unterschied von Prozessorientierung und Prozessmanagement beachten.
2. Artikel zu einzelnen Prozessen und Verfahren
a) Entwicklung
Alle Hersteller müssen einen Entwicklungsprozess festlegen. Dazu sollten sie die Abgrenzung und das Zusammenspiel von Entwicklungsplan und Entwicklungsprozess verstehen.
Bei der Software-Entwicklung nutzen viele Hersteller agile Entwicklungsmodelle. Die Dokumentation hingegen sollte eher einem Modell folgen, das an das V-Modell erinnert.
Ein Teil der Entwicklung umfasst das Risikomanagement bzw. den Risikomanagementprozess. Dabei müssen die Hersteller auch die Risiken durch unzureichende Prozesse analysieren, etwa mit einer Prozess-FMEA (pFMEA).
b) Nachgelagerte Phase
Die Prozesse müssen den ganzen Lebenszyklus der Produkte abdecken:
3. Unterstützung
Das Johner Institut hilft Herstellern von Medizinprodukten dabei, schlanke und normenkonforme Prozesse und Verfahren festzulegen.
Damit gelingt es Ihnen, Ihre Produkte in der geplanten Zeit und mit den geplanten Kosten schnell und sicher zu entwickeln und in den Markt zu bringen.
Melden Sie sich, damit wir gemeinsam einen Plan erstellen können, wie Sie in kurzer Zeit und zu minimalen Kosten diese Prozesse und Verfahren bei sich etablieren.
Die ISO/IEC 42001 trägt den Titel „Information technology – Artificial intelligence – Management system“. Erste Medizinproduktehersteller haben sich auf den Weg gemacht, sich nach dieser Norm zertifizieren zu lassen. Doch sind die Aufwände dafür gerechtfertigt? Hilft die ISO/IEC 42001 dabei, die Anforderungen des AI Act zu erfüllen? Antworten gibt dieser Artikel.
Details
Die Norm ISO 15189 „Medizinische Laboratorien – Anforderungen an die Qualität und Kompetenz“ legt die Anforderungen an ein Qualitätsmanagementsystem für medizinische Labore fest. Labore sind gesetzlich verpflichtet, ein QM-System zu etablieren. Labore, die Inhouse-IVD betreiben, benötigen ein QM-System nach ISO 15189, das um zusätzliche Kapitel erweitert werden muss. Dieser Artikel
Details
Die europäische Medical Device Regulation MDR (EU-Medizinprodukteverordnung) müssen Hersteller beachten, die Medizinprodukte in der EU in den Verkehr bringen wollen. Diese Verordnung (EU) 2017/745 über Medizinprodukte, so der offizielle Titel, stellt auch Anforderungen an Benannte Stellen, Händler, Importeure und Gesundheitseinrichtungen wie Krankenhäuser.
Details
MDR und IVDR sowie die ISO 13485:2016 formulieren ebenso wie die FDA klare Anforderungen an die Lieferantenbewertung, Lieferantenauswahl und Lieferantenüberwachung. Dieser Artikel verschafft Ihnen einen Überblick über die regulatorischen Anforderungen an das Lieferantenmanagement. Er gibt zudem Tipps zur praxisnahen Umsetzung und verrät, wann ein Lieferantenaudit notwendig ist.
Details
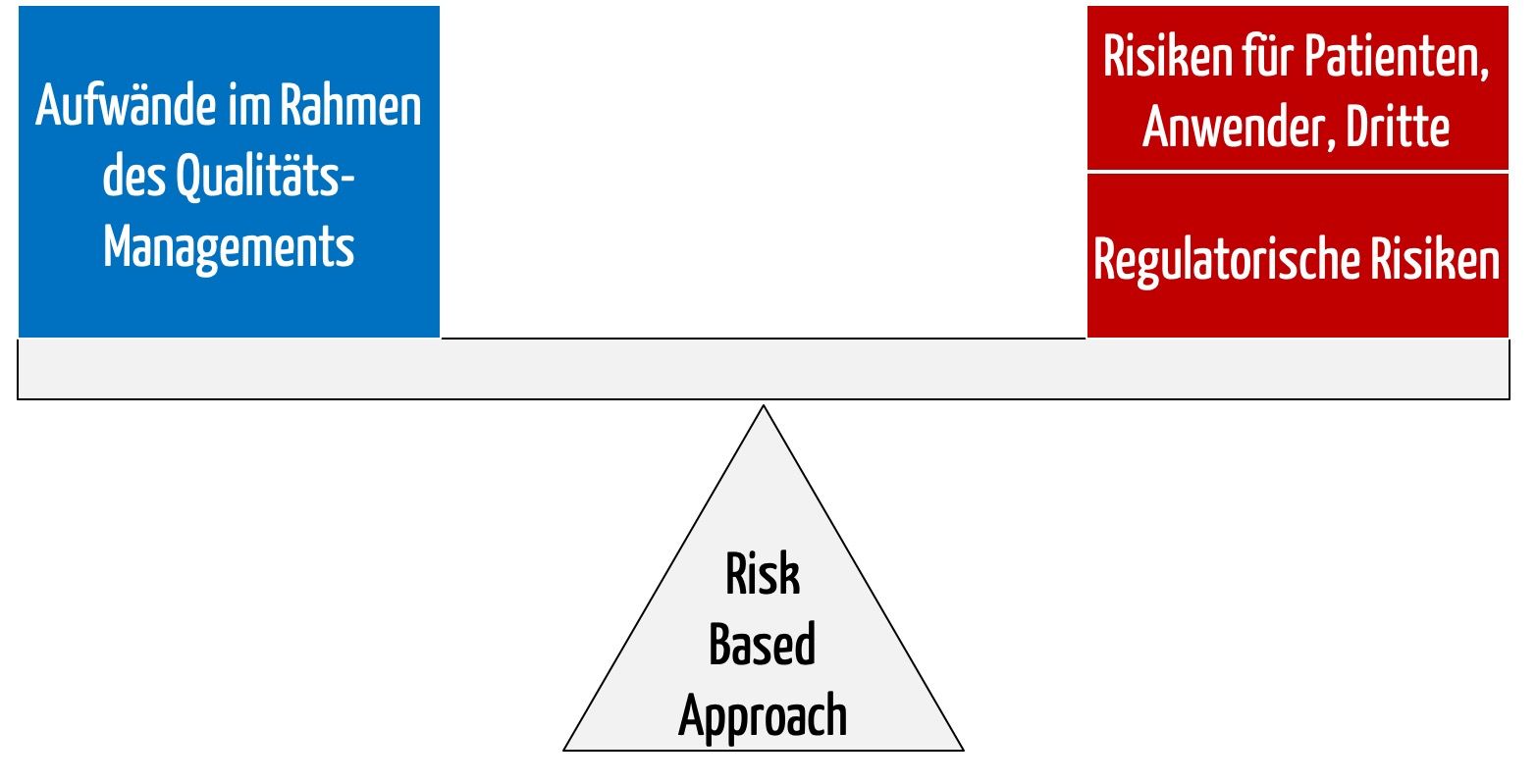
Viele Behörden und Regularien sprechen von einem Risk-Based Approach (RBA), auf Deutsch: risikobasierter Ansatz. Allerdings definieren sie diesen Begriff nicht und nennen auch keine Beispiele. Dieser Artikel verschafft einen Überblick darüber, wie das Risikomanagement und die ISO 13485 zusammenspielen und was ein „Risk-Based Approach“ ist und gibt konkrete Hinweise dazu, wie
Details
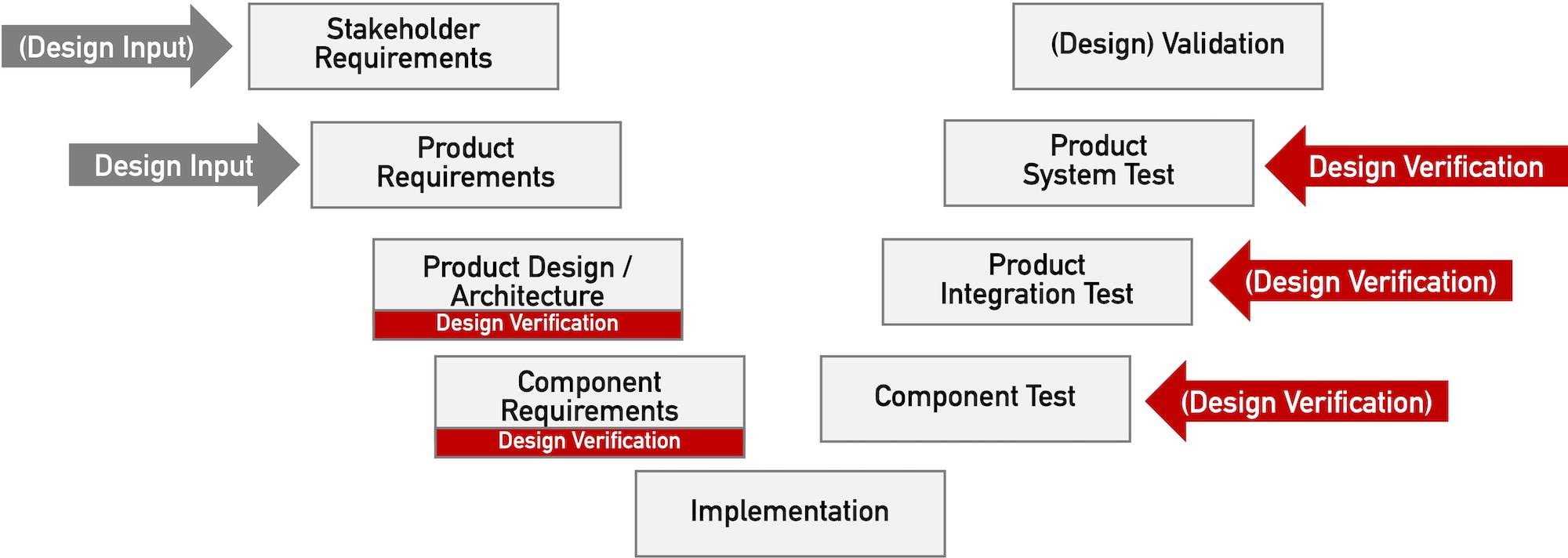
Die Forderung nach „Design Verification“ erhebt keinesfalls nur die FDA. Dieser Beitrag beschreibt, was unter „Design Verification“ zu verstehen ist und welche regulatorischen Forderungen Medizinproduktehersteller erfüllen sollten.
Das Medical Device Single Audit Program (MDSAP) wurde ins Leben gerufen, um einen Wunsch vieler Medizinproduktehersteller zu erfüllen: Statt vieler Audits und Inspektionen durch die Behörden verschiedener Länder soll es nur noch eines geben. Die Teilnahme am MDSAP soll ausreichen, um die Wirksamkeit und Konformität von QM-Systemen (z. B. Konformität mit ISO 13485 oder 21…
Details
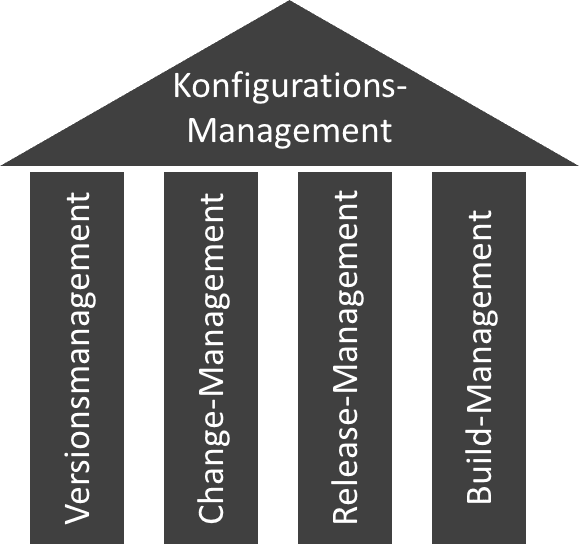
Konfigurationsmanagement ist weit mehr als nur der Einsatz von Versionsverwaltungswerkzeugen wie git oder svn. Dies wird bei einem Blick in die IEC 62304 und die Guidance-Dokumente der FDA sofort klar. Lesen Sie in diesem Artikel,
Details
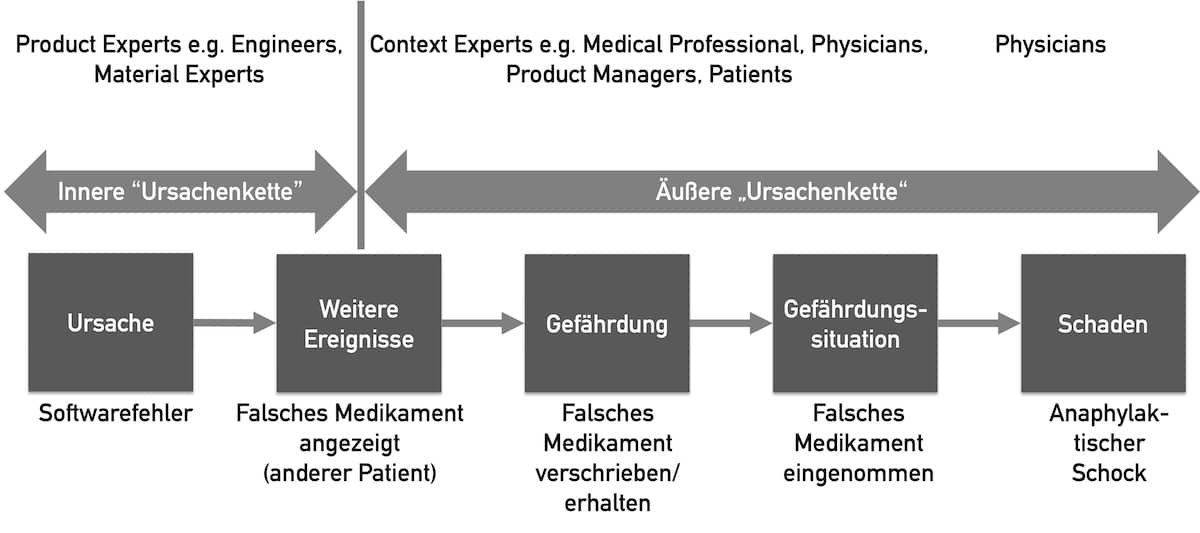
Die ISO 14971 definiert die Begriffe Gefährdung und Gefährdungssituation. Trotzdem fällt es Medizinprodukte-Herstellern oft schwer, den beiden Begriffen Sachverhalte zuzuordnen. Dieser Artikel gibt Hilfestellung.
AQL steht für Acceptable Quality Level und wird manchmal mit „erlaubte Ausschussquote“ übersetzt. Das AQL bestimmt, wann ein Los an Teilen oder Produkten auf Basis einer Stichprobenprüfung zurückgewiesen bzw. akzeptiert wird. Doch regelmäßig akzeptieren Auditoren das AQL nicht mehr. Was tun? Dieser Artikel gibt Antworten. 1. Wen das Thema „AQL“ wann betrifft 1.1 Betroffene Rollen…
Details