Viele regulatorische Vorgaben fordern die Hersteller auf, Prozesse und Verfahren festzulegen. Solche Forderungen stellen beispielsweise die EU-Verordnungen (MDR und IVDR), Normen wie die ISO 13485, IEC 62304 und ISO 14971 sowie die FDA.
Inhalt
Sie finden auf dieser Seite Verweise auf Fachartikel zu Prozessen und Verfahren:
- Artikel zu Prozessen und Verfahren im Allgemeinen
- Artikel zu einzelnen Prozessen und Verfahren
- Hinweise zur Unterstützung bei Prozessen und Verfahren
1. Artikel zu Prozessen und Verfahren im Allgemeinen
a) Abgrenzung von Prozessanweisungen und Verfahrensanweisungen
Die Beschreibung von Prozessen und Verfahren unterscheidet sich in ihrem Granularitätsgrad. Prozesse beschreiben, WAS gemacht wird. Verfahrensanweisungen beschreiben, WIE etwas gemacht wird.
Aber die regulatorischen Anforderungen unterscheiden beides nicht immer präzise.
Alle Anweisungen müssen letztlich bestimmen,
- wer wann was in welcher Reihenfolge auf welche Weise macht
- und dabei welchen Input in welchen Output überführt.
b) Artikel
Die Prozesse und Verfahren sind Teil des Qualitätsmanagements. Diese Übersichtseite verschafft einen guten Einstieg in das Thema Qualitätsmanagement.
Hilfreich sind die Artikel zum Erstellen von Prozess- und Verfahrensanweisungen sowie zum risikobasierten Ansatz bei Prozessen. Das Schreiben dieser Vorgabedokumente sollte nur bei ausgewählten Prozessen die Aufgabe des QM-Beauftragten sein.
Sind die Prozesse definiert, müssen sie einer Prozessvalidierung unterworfen werden.
Hersteller sollten den Unterschied von Prozessorientierung und Prozessmanagement beachten.
2. Artikel zu einzelnen Prozessen und Verfahren
a) Entwicklung
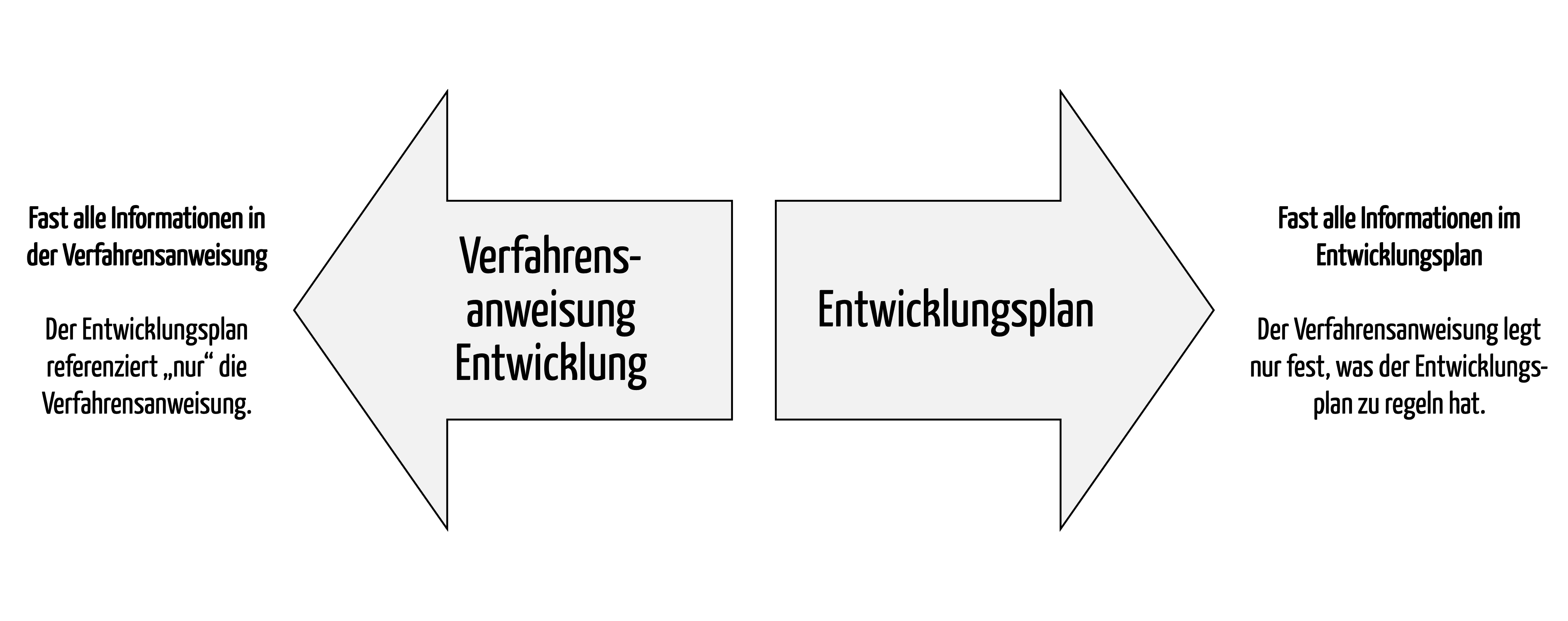
Alle Hersteller müssen einen Entwicklungsprozess festlegen. Dazu sollten sie die Abgrenzung und das Zusammenspiel von Entwicklungsplan und Entwicklungsprozess verstehen.
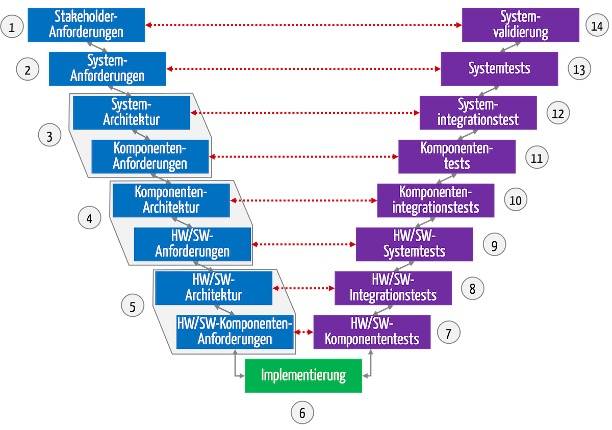
Bei der Software-Entwicklung nutzen viele Hersteller agile Entwicklungsmodelle. Die Dokumentation hingegen sollte eher einem Modell folgen, das an das V-Modell erinnert.
Ein Teil der Entwicklung umfasst das Risikomanagement bzw. den Risikomanagementprozess. Dabei müssen die Hersteller auch die Risiken durch unzureichende Prozesse analysieren, etwa mit einer Prozess-FMEA (pFMEA).
b) Nachgelagerte Phase
Die Prozesse müssen den ganzen Lebenszyklus der Produkte abdecken:
3. Unterstützung
Das Johner Institut hilft Herstellern von Medizinprodukten dabei, schlanke und normenkonforme Prozesse und Verfahren festzulegen.
Damit gelingt es Ihnen, Ihre Produkte in der geplanten Zeit und mit den geplanten Kosten schnell und sicher zu entwickeln und in den Markt zu bringen.
Melden Sie sich, damit wir gemeinsam einen Plan erstellen können, wie Sie in kurzer Zeit und zu minimalen Kosten diese Prozesse und Verfahren bei sich etablieren.
Die EU-Verordnungen stellen hohe Anforderungen an die sogenannte Inverkehrbringung von Medizinprodukten. Erfahren Sie in diesem Artikel, was diese Regularien unter einer Inverkehrbringung verstehen, welche Missverständnisse und Widersprüche Sie kennen müssen und welche Voraussetzung die Hersteller bzw. Produkte erfüllen müssen.
Details
Die Digitalisierung der Produktion ist ein wesentlicher Bestandteil der digitalen Transformation von produzierenden Unternehmen. Doch nicht alle Unternehmen profitieren im gleichen Maß von Digitalisierungsmaßnahmen. Dieser Artikel beschreibt,
Details
Lastenheft und Pflichtenheft, Systemspezifikation und Systemanforderungen Die Vorstellungen darüber, was Lastenhefte und Pflichtenhefte enthalten müssen, gehen weit auseinander – manchmal auch innerhalb einer Firma. Das liegt u. a. daran, dass die beiden Dokumente die verschiedenen Anforderungstypen nicht konsequent unterscheiden. Vielmehr unterscheiden sie sich in der Granularität und dem Detailgrad. Schon aus regulatorischer Sicht sollten Sie…
Details
Der Risikomanagementplan ist eines der wichtigsten Dokumente der Technischen Dokumentation. Entsprechend intensiv prüfen Behörden und Benannte Stellen diesen Plan. Doch nicht nur aus regulatorischer Sicht profitieren Medizinproduktehersteller von einem präzisen Risikomanagementplan. Dieser Beitrag
Details
Die FMEA, die Failure Mode and Effect Analysis (auf Deutsch „Fehlermöglichkeits- und -einflussanalyse“) ist ein Verfahren, um zu bekannten Ursachen unbekannte Auswirkungen zu untersuchen. Bei Medizinprodukten nutzt man die FMEA beispielsweise bei der Risikoanalyse, um die Folgen einer fehlerhaften Komponente zu analysieren, insbesondere die sich daraus ergebende Gefährdungen.
Details
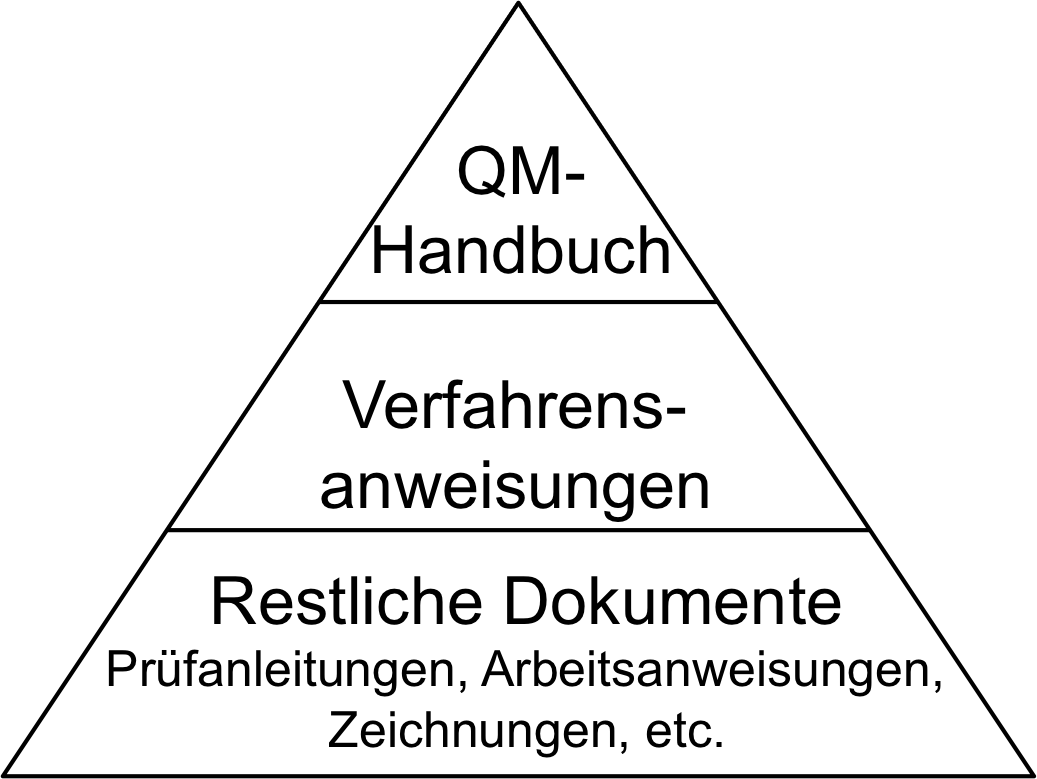
Das QM-Handbuch stellt in der Dokumentenpyramide des QM-Systems das oberste Dokument dar. Es dient als Einstiegspunkt für Mitarbeiter und Auditoren, um einen schnellen Überblick über das QM-System zu verschaffen. Erfahren Sie in diesem Beitrag, wann Sie ein QM-Handbuch benötigen, welche Ziele es verfolgt und welche Inhalte es enthalten sollte.
Details
Der TIR45 („Guidance on the use of AGILE practices in the development of medical device software“) ist ein Technical Information Report (daher TIR) der AAMI, der Association for the Advancement of Medical Instrumentation. Der 2012 erstmalig veröffentlichte TIR45 hat sich vor allem ein Ziel gesetzt: Medizinprodukte-Herstellern eine Anleitung zu geben, wie sie Software agil und…
Details
Die Trendanalyse ist eine gesetzliche Pflicht aller Medizinproduktehersteller, insbesondere bei der „Post-Market Surveillance“. Bei der Wahl und Anwendung geeigneter statistischer Methoden für die Trendanalyse dürfen die Hersteller nicht scheitern. Denn der Fokus von Behörden und Benannten Stellen verschiebt sich zunehmend auf die Überwachung der Post-Market-Aktivitäten. Dieser Artikel gibt eine schnelle Einführung in das komplexe Thema,…
Details
Das V-Modell ist ein Entwicklungsprozessmodell, das ursprünglich bei staatlichen Projekten (u. a. Rüstung) zur Anwendung kam. Bis heute ist es bei Projekten im regulierten Umfeld (z. B. Medizintechnik, Banken) in vielen Köpfen und Normen verankert. Das führt zu Konflikten in Teams, die agile Entwicklungsprozesse bevorzugen. Dieser Artikel hilft, diesen Widerspruch aufzulösen. Sie erfahren, wie Sie…
Details
Medizinproduktehersteller sind verpflichtet, sowohl den Entwicklungsprozess zu beschreiben als auch einen Entwicklungsplan zu erstellen. Weil beide Dokumente Vorgaben dazu machen, wie Medizinprodukte zu entwickeln sind, gibt es Unsicherheit darüber, welche Information in welches Dokument gehört. Dieser Artikel löst das auf und betrachtet dabei auch die Software. Er geht ein auf den Software-Entwicklungsplan und die Beschreibung…
Details