Hersteller von Medizinprodukten müssen Kriterien für die Risikoakzeptanz festlegen. Dies geschieht oft auf zwei Ebenen:
- In der Risikopolitik (s. ISO 14971, Kapitel 4.2)
- Im Risikomanagementplan (s. ISO 14971, Kapitel 4.4)
Risikopolitik
In der Risikopolitik legt ein Hersteller (produktübergreifend) fest, wie er vorgeht, um die (produktspezifischen) Kriterien für die Risikoakzeptanz zu bestimmen.
Beispiele
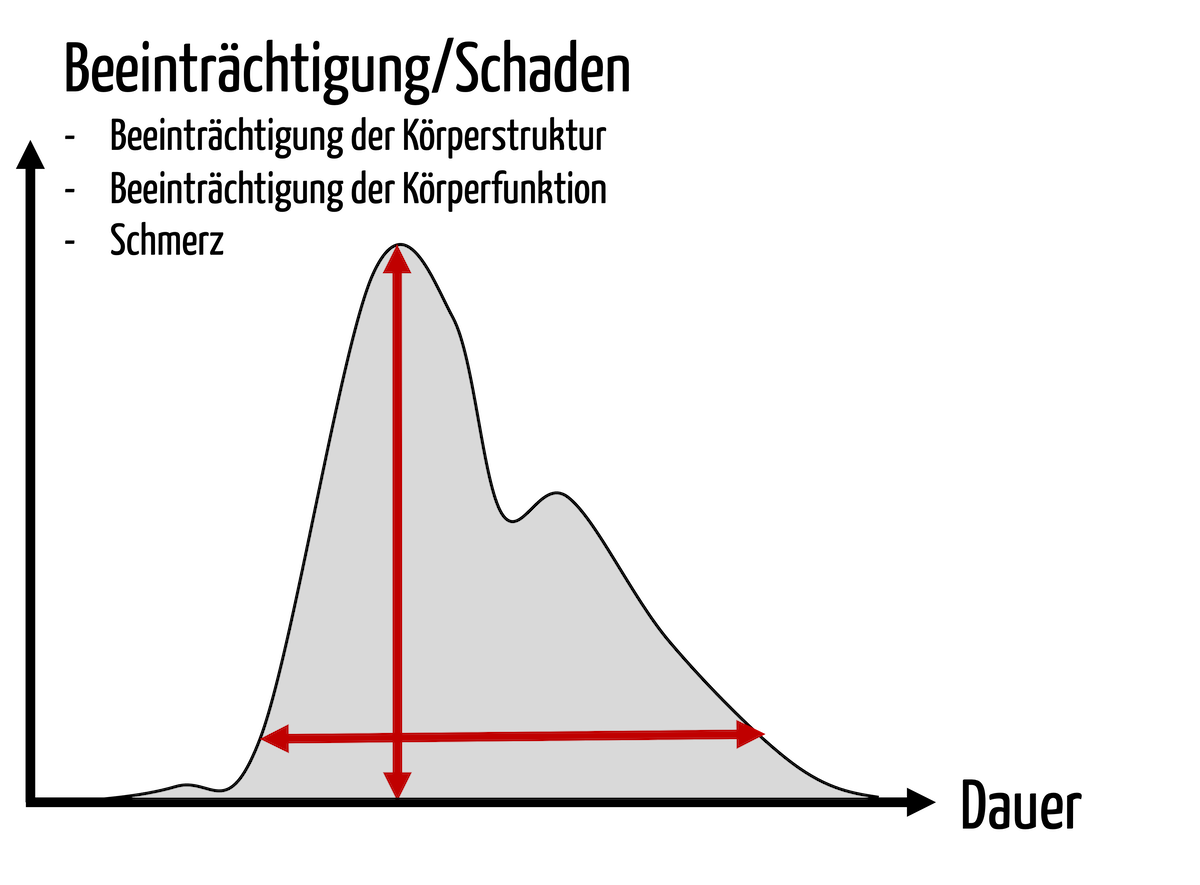
- Kein Produkt darf zu Risiken mit einem katastrophalen Schweregrad von Schäden (z. B. Tod) führen. (Das könnte dazu führen, dass der Hersteller bestimmte Produkte nicht mehr in den Markt bringen kann.)
- Die Risiken müssen bei jedem Produkt so weit wie möglich minimiert werden. Bei der Risikominimierung dürfen ökonomische Erwägungen keine Rolle spielen. (Beides ist bereits regulatorisch gefordert.)
- Risiken, die nicht zu einem messbaren Schaden führen, sind generell akzeptabel, es sei denn, dies entspräche nicht dem Stand der Technik (z. B. eine kleine Verzögerung einer zeitlich nicht kritischen Diagnose).
Ihre Risikopolitik können Hersteller in einem eigenen Dokument oder als Teil einer Verfahrensanweisung zum Ausdruck bringen.
Risikoakzeptanz
Für jedes Produkt müssen Hersteller die Risikoakzeptanzkriterien bestimmen. Das geschieht üblicherweise in Form einer Risikoakzeptanzmatrix.
Weiterführende Informationen
Die Kriterien für die Risikoakzeptanz müssen den Vorgaben der Risikopolitik genügen.
Die korrekte und präzise Formulierung der Zweckbestimmung von Medizinprodukten und In-Vitro-Diagnostika (IVD) ist entscheidend für deren erfolgreiche Entwicklung und Zulassung. Doch bereits die Begriffsdefinitionen und die Abgrenzung von Zweckbestimmung und bestimmungsgemäßem Gebrauch erschweren die notwendige Klarheit und Präzision. Dieser Artikel verrät, wie Sie eine Zweckbestimmung formulieren, um Schwierigkeiten bei Audits und Zulassungen zu vermeiden.
Details
Medizinproduktehersteller müssen die Schweregrade möglicher Schäden bestimmen, um die Risiken durch ihre Produkte bewerten zu können. Was sich einfach anhört, ist in der Praxis sehr herausfordernd. Dieser Artikel gibt Hilfestellung, um die Schweregrade dieser Schäden ISO 14971-konform zu bestimmen und zu dokumentieren.
Details
Die EU-Medizinprodukteverordnung (MDR) reguliert nicht nur Medizinprodukte, sondern auch Produkte ohne medizinische Zweckbestimmung, z. B. Geräte zur Fettabsaugung, Brustimplantate oder farbige Kontaktlinsen. Im Dezember 2022 – viereinhalb Jahre nach Erscheinen der MDR – hat die EU mit zwei Durchführungsverordnungen (2022/2346 und 2022/2347) notwendige Details geregelt. Für Hersteller dieser Produkte sind besonders die folgenden Quellen relevant:…
Details
Dieser Artikel nennt die sieben häufigsten Fehler beim Risikomanagement, auf welche das Johner Institut und seine Auditoren am häufigsten stoßen. Er gibt auch Tipp dazu, wie sich diese Fehler vermeiden lassen. Das Risikomanagement zählt zu den wichtigsten Anforderungen, die Medizinproduktehersteller erfüllen müssen. Deshalb ist es wichtig, dass sie Fehler beim Risikomanagement vermeiden.
Details
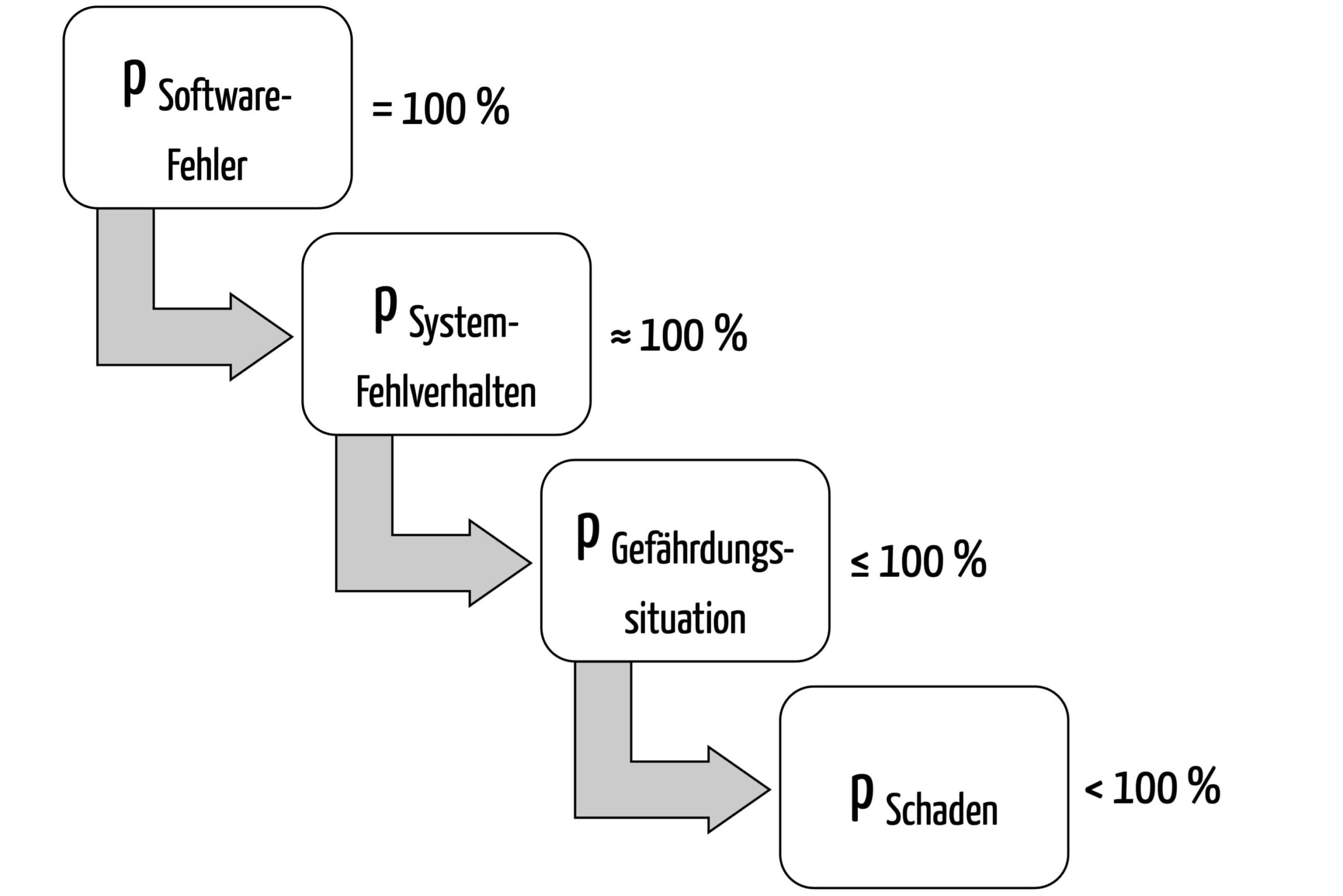
Die Fehlerwahrscheinlichkeit bei Software lässt sich schwer abschätzen. So schwer, dass die „alte“ DIN EN IEC 62304:2006 schrieb: „Es gibt jedoch keine Übereinstimmung, wie die Wahrscheinlichkeit des Auftretens von Software-Ausfällen unter Verwendung von traditionellen statistischen Methoden bestimmt werden kann.“ Die Norm schlussfolgerte, dass „die Wahrscheinlichkeit einer solchen Fehlfunktion als 100 Prozent angenommen werden muss“. Die hochproblematische…
Details
Gesetze und Normen verlangen von Organisationen, einen Risikomanagementbericht zu erstellen. Benannte Stellen und Behörden prüfen diese Berichte besonders intensiv, weil das Risikomanagement eine zentrale regulatorische Anforderung ist. Deshalb ist es (nicht nur) für Hersteller wichtig, dass sie präzise, vollständige und korrekte Risikomanagementberichte erstellen. Dafür gibt dieser Artikel Hilfestellung.
Details
MDR und IVDR fordern von den Medizinprodukteherstellern entweder einen Post-market Surveillance Report („Bericht über die Überwachung nach dem Inverkehrbringen“) oder einen Periodic Safety Update Report („Regelmäßig aktualisierter Bericht über die Sicherheit“). Den Periodic Safety Update Report kürzt man meist als „PSUR“ ab, den Post-market Surveillance Report als „PMS-Report“.
Details
Die dritte Ausgabe der ISO 14971 steht seit Dezember 2019 bereit. Die neue Version der ISO 14971 wurde als ISO 14971:2019 publiziert. Sie ist eine evolutionäre Weiterentwicklung der ISO 14971:2007 und bricht nicht mit den bisherigen Konzepten. Hersteller sollten sich mit den neuen und geänderten Anforderungen dieser Norm vertraut machen. Noch im Dezember…
Details
Firmen, die beispielsweise einen Bezug zur Pharmaindustrie haben, verwenden die Risikoprioritätszahl (RPZ). Es gibt jedoch Branchen, in denen das Risiko nicht über eine RPZ bewertet werden darf. Beispielsweise in der Medizintechnik ist die Definition der Risikoprioritätszahl nicht konform mit der Definition des Begriffs Risiko gemäß der ISO 14971. Das kann im Audit und bei Produktzulassungen zu Beanstandungen führen.
Details
Der TIR 57 ist ein „Technical Information Report“ der amerikanischen AAMI. Er möchte Hilfestellung dabei geben, Risiken durch mangelnde IT-Sicherheit von Medizinprodukten zu erkennen und zu beherrschen und so die Anforderungen der ISO 14971 an das Risikomanagement zu erfüllen.
Details