Hersteller von Medizinprodukten müssen Kriterien für die Risikoakzeptanz festlegen. Dies geschieht oft auf zwei Ebenen:
- In der Risikopolitik (s. ISO 14971, Kapitel 4.2)
- Im Risikomanagementplan (s. ISO 14971, Kapitel 4.4)
Risikopolitik
In der Risikopolitik legt ein Hersteller (produktübergreifend) fest, wie er vorgeht, um die (produktspezifischen) Kriterien für die Risikoakzeptanz zu bestimmen.
Beispiele
- Kein Produkt darf zu Risiken mit einem katastrophalen Schweregrad von Schäden (z. B. Tod) führen. (Das könnte dazu führen, dass der Hersteller bestimmte Produkte nicht mehr in den Markt bringen kann.)
- Die Risiken müssen bei jedem Produkt so weit wie möglich minimiert werden. Bei der Risikominimierung dürfen ökonomische Erwägungen keine Rolle spielen. (Beides ist bereits regulatorisch gefordert.)
- Risiken, die nicht zu einem messbaren Schaden führen, sind generell akzeptabel, es sei denn, dies entspräche nicht dem Stand der Technik (z. B. eine kleine Verzögerung einer zeitlich nicht kritischen Diagnose).
Ihre Risikopolitik können Hersteller in einem eigenen Dokument oder als Teil einer Verfahrensanweisung zum Ausdruck bringen.
Risikoakzeptanz
Für jedes Produkt müssen Hersteller die Risikoakzeptanzkriterien bestimmen. Das geschieht üblicherweise in Form einer Risikoakzeptanzmatrix.
Weiterführende Informationen
Die Kriterien für die Risikoakzeptanz müssen den Vorgaben der Risikopolitik genügen.
Der TIR 57 ist ein „Technical Information Report“ der amerikanischen AAMI. Er möchte Hilfestellung dabei geben, Risiken durch mangelnde IT-Sicherheit von Medizinprodukten zu erkennen und zu beherrschen und so die Anforderungen der ISO 14971 an das Risikomanagement zu erfüllen.
Details
Der Begriff „kritische Bauteile“ wird häufig im Kontext der IEC 60601-1 verwendet. Beispielsweise sei eine „Liste kritischer Bauteile“ zu erstellen. Auch wenn die Norm den Begriff „kritisches Bauteil“ weder verwendet noch definiert, gibt es Gründe, eine solche Liste an Bauteilen zu führen. Inhaltsübersicht Begriff und Beispiele » Regulatorische Anforderungen » Wann ist eine Komponente kritisch?…
Details
Unter „Design Input“ versteht man die Entwicklungsvorgaben, an die nicht nur die FDA konkrete Forderungen stellt. Dieser Artikel beschreibt, welche Inhalte Ihr Design Input enthalten sollte. Sie erfahren, wie das Risikomanagement mit dem Design Input zusammenspielt. Inhaltsübersicht Definition „Design Input“ » Regulatorische Anorderungen » Inhalte des Design Inputs » Risikoanalyse als Design Input »
Details
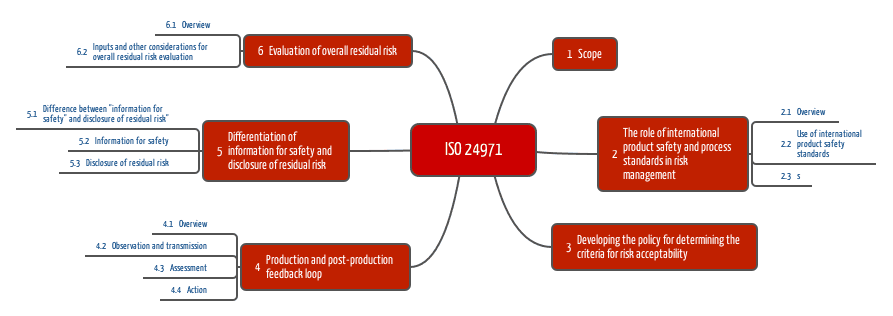
Die ISO 24971 ist die Norm, die meine Auditoren-Kollegen oft zücken, wenn es mit Medizinprodukte-Hersteller Diskussionen über die Auslegung der ISO 14971 gibt. Sie kennen die ISO 24971 nicht? Sie möchten diese Norm nicht kaufen? Kein Problem, ich habe diese Technical Report für Sie gelesen und zusammengefasst.
Details
Sie glauben als Medizinprodukte-Hersteller, dass Sie das Thema Health Technology Assessment HTA nicht betrifft? Das kann täuschen. Es gibt zwei Gründe, weshalb Sie sich mit HTA beschäftigen sollten. Inhaltsübersicht Ziele von HTA » HTA für Medizinproduktehersteller » Beispiele (Software) » Abgrenzung zu klinischen Studien »
Details
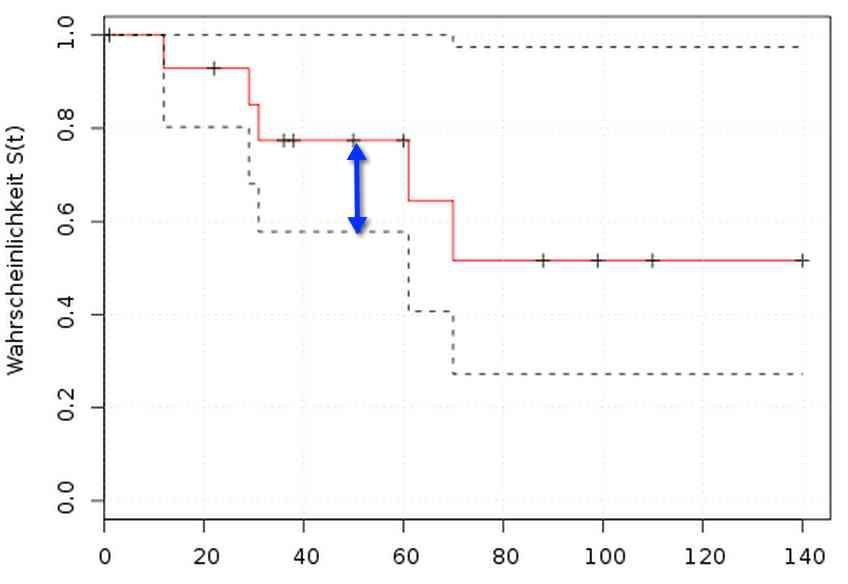
Mit Schätzungen nach Kaplan-Meier können Sie beispielsweise die Überlebenswahrscheinlichkeit abschätzen, dass Ihre Patienten trotz oder wegen Ihres Medizinprodukts überleben. Während in der Pharma-Forschung diese Kaplan-Meier-Kurven Stand der Technik sind, werden sie von Medizinprodukteherstellern häufig ignoriert. Dabei gibt es viele Fälle, in denen Ihnen die Kaplan-Meier-Statistik regulatorisch relevante Informationen liefern könnte.
Die WHO gibt die „International Classification of Functioning, Disability and Health“ (ICF) heraus, das DIMDI die deutsche Ausgabe, die „Internationale Klassifikation der Funktionsfähigkeit, Behinderung und Gesundheit“. Inhaltsübersicht Ziel der ICF » Aufbau der ICF » ICF im Risikomanagement » ICF und IEC 62304 » Diese Taxonomie ist nicht nur im Rahmen der Pflegedokumentation hilfreich, sondern…
Details