Der Bereich „Regulatory Affairs“ umfasst über 200 Aufgaben, die bei der Entwicklung und Zulassung von Medizinprodukten zu erledigen sind.
Sie finden hier eine Übersicht über die wichtigsten Inhalte, damit Sie Ihr Produkt schnell zulassen können.
Inhalt
Sie finden auf dieser Seite Fachartikel zu diesen Themen:
- Was Regulatory Affairs ist
- Regulatorische Anforderungen
- Zulassung und Dokumentation
- Behörden, Institutionen und Verbänden
- Weitere Themen der Regulatory Affairs
1. Was Regulatory Affairs ist
Regulatory Affairs umfasst die Prozesse und Aktivitäten, die sicherstellen, dass Medizinprodukte die regulatorischen Anforderungen der Länder erfüllen, in denen sie verkauft werden sollen. Dazu gehören die
- Einholung der erforderlichen Genehmigungen und Freigaben von den Aufsichtsbehörden,
- Einhaltung der geltenden Vorschriften und Normen sowie
- Aufrechterhaltung der Konformität während des gesamten Produktlebenszyklus bis zur Außerbetriebnahme.
Zu den Aufgaben des Bereichs Regulatory Affairs gehört auch die Überwachung von Änderungen der Vorschriften und Normen und die Kommunikation dieser Änderungen mit den Interessengruppen innerhalb des Unternehmens, um eine kontinuierliche Einhaltung zu gewährleisten.
Damit spielt Regulatory Affairs eine entscheidende Rolle, wenn es darum geht, sicherzustellen, dass Medizinprodukte sicher und wirksam sind und den gesetzlichen Anforderungen entsprechen.
2. Regulatorische Anforderungen
a) Deutschland
b) Europa
c) USA
d) Andere Märkte
3. Zulassung und Dokumentation
a) Zulassung
Finden Sie weitere Informationen zur internationalen Zulassung.
b) Qualifizierung und Klassifizierungen (Wie ist mein Produkt einzuteilen?)
c) Technische Dokumentation (Was muss ich pro Produkt dokumentieren?)
d) Qualitätsmanagement (Was sollte Ihre Firma erfüllen?)
Das Qualitätsmanagement zählt üblicherweise nicht zur Verantwortung von Regulatory Affairs. Dennoch listen wir Ihnen einige wichtige Artikel.
4. Behörden, Institutionen und Verbände
a) Deutschland
| BfArM: Bundesamt für Arzneimittel und Medizinprodukte |
| DIMDI (Deutsches Institut für medizinische Informatik; wurde inzwischen in das BfArM integriert) |
| DAkkS, die deutsche Akkreditierungsstelle |
| Länderbehörden: Regierungspräsidien, Gewerbeaufsichtsämter, Regierungen |
b) Europa
c) International
| IMDRF: International Medical Device Regulators Forum |
5. Regulatory Affairs: Weitere Themen
Sie finden hier einen Artikel über die Aufgaben und Kompetenzen von Regulatory Affairs Manager.
Die Aufgaben von Regulatory Affairs umfassen auch das Finden und Beseitigen von Abweichungen und Nicht-Konformitäten.
Beachten Sie die Vor- und Nachteile von Regulatory Information Management Systemen (RIMS) und deren Rolle bei der digitalen Transformation der Hersteller.
Ein Teil der Aufgaben von Regulatory Affairs ist die Regulatory Intelligence.
Wenn regulatorische Anforderungen nicht erfüllt sind, ist häufig eine Remediation erforderlich.
Benötigen Sie Unterstützung?
Haben Sie noch Fragen, beispielsweise zur Zulassung Ihrer Produkte? Dann nutzen Sie das kostenfreie Micro-Consulting.
Falls Sie Unterstützung dabei wünschen, Ihre Medizinprodukte gesetzeskonform zu entwickeln und „zuzulassen“, dann nehmen Sie gleich Kontakt auf. Das Team das Johner Instituts hilft gerne!
Die Medical Device Coordination Group (MDCG) hat ein Guidance Document entworfen, das beschreibt, wie Hersteller ihre Medizinprodukte der Klasse 1 MDR-konform in den Verkehr bringen sollen. Das Dokument trägt den Titel Guidance Notes for Manufacturers of Class I Medical Devices. Dieser Artikel fasst dieses Dokument zusammen und gibt Herstellern dieser Produkte Tipps.
Details
Die Medizinprodukte-Betreiberverordnung (MPBetreibV) ist eine nationale deutsche Verordnung, die Anforderungen an das Betreiben und Benutzen von Medizinprodukten stellt.
Medizinprodukte- und IVD-Hersteller müssen die Konzepte „anormaler Gebrauch“, „vorhersehbarer Missbrauch“, „Fehler beim bestimmungsgemäßen Gebrauch“ und „Fehlanwendung“ unterscheiden. Das ist die Voraussetzung, um die Anforderungen der ISO 14971 und IEC 62366 zu verstehen und zu erfüllen. Selbst die Maßnahmen, die Hersteller ergreifen müssen, hängen von der Art des Gebrauchs ab.
Details
Medizinprodukte über das Ende der Lebensdauer hinaus zu betreiben kann gefährlich und rechtlich problematisch sein. Daher sollten Hersteller die genaue Lebensdauer bei jedem Produkt präzise bestimmen. Doch könnten Sie auf die Schnelle sagen, wie Lebensdauer definiert oder nach welchen Kriterien sie bestimmt wird? Verwandte Begriffe wie „Nutzungsdauer“, “Haltbarkeit”, “Betriebszeit” bzw. „Service Life“ und „Shelf Life“…
Details
„Remediation“ ist oft ein Synonym für maximalen Stress: Benannte Stellen oder Behörden wie die FDA haben nennenswerte Abweichungen entdeckt, die mit höchster Priorität und ohne Rücksicht auf die Arbeitslast der Mitarbeitenden oder Budgets beseitigt werden müssen. Dieser Artikel hilft Ihnen, solche „Remediation-Projekte“ so abzuschließen, dass
Details
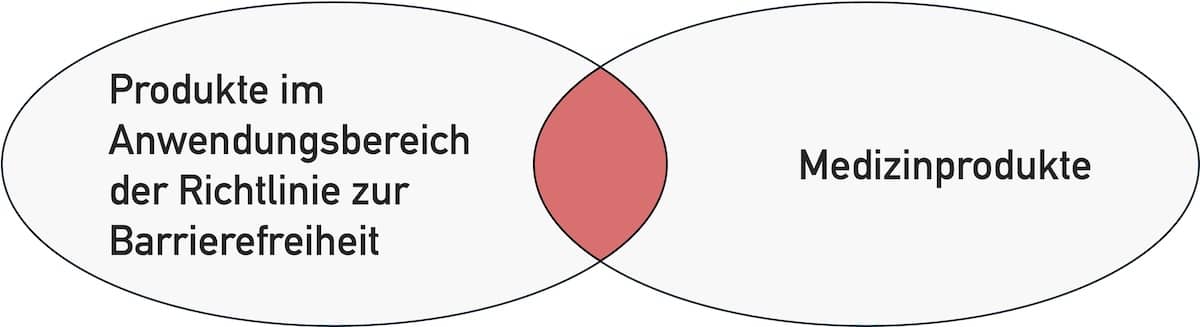
Unter der Barrierefreiheit – auf Englisch Accessibility – versteht man die Gestaltung von Angeboten, die auch von Menschen mit körperlichen Einschränkungen genutzt werden können. Der Begriff ‚Angebote‘ umfasst Bauwerke ebenso wie digitale und nichtdigitale Produkte. Das schließt auch Medizinprodukte (Geräte, App, Standalone-Software) ein. Welche Anforderungen an die Accessibility Hersteller von Medizinprodukten beachten sollten, um der…
Details
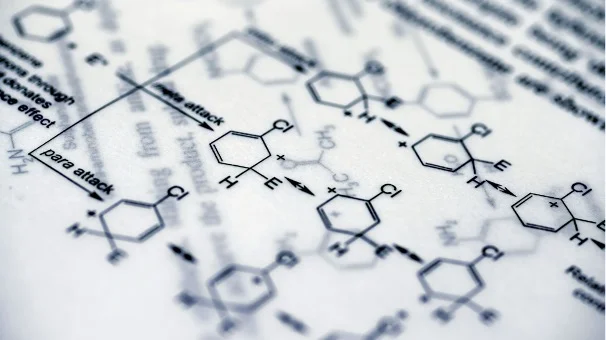
Die chemische Charakterisierung nach ISO 10993-18 ist ein zentraler Bestandteil der Biokompatibilitätsbewertung gemäß ISO 10993-1 und damit eine Voraussetzung für die Zulassung von Medizinprodukten. Sie dient dazu, unbekannte Substanzen in Medizinprodukten zu identifizieren, um eine toxikologische Risikobewertung durchführen zu können. Dieser Artikel verschafft einen Überblick über
Details
Der Einsatz von CMR-Stoffen ist streng reguliert. Auch die MDR regelt die CMR-Stoffe und stellt strenge Anforderungen an die Medizinproduktehersteller. Dieser Artikel hilft, diese Anforderungen zu erfüllen.
Details
Die FDA hat die Bedeutung der Interoperabilität von Medizinprodukten früh erkannt und 2017 das Guidance Dokument ‚Interoperable Medical Devices‘ veröffentlicht. Die US-Behörde möchte damit der Tatsache Rechnung tragen, dass die Interoperabilität von Medizinprodukten einerseits wichtig für die Gesundheitsversorgung ist. Andererseits führen Probleme mit mangelnder Interoperabilität zu Risiken. Dieser Beitrag verschafft Ihnen einen schnellen Überblick über…
Details
Um die Einstufung ihres stofflichen Medizinprodukts als solches und nicht als Arzneimittel zu erreichen, müssen Hersteller oft nachweisen, dass komplexe Inhaltsstoffe primär durch physikalische Mechanismen wirken. Dieser Fachartikel gibt Hilfestellungen.
Details