Der Bereich „Regulatory Affairs“ umfasst über 200 Aufgaben, die bei der Entwicklung und Zulassung von Medizinprodukten zu erledigen sind.
Sie finden hier eine Übersicht über die wichtigsten Inhalte, damit Sie Ihr Produkt schnell zulassen können.
Inhalt
Sie finden auf dieser Seite Fachartikel zu diesen Themen:
- Was Regulatory Affairs ist
- Regulatorische Anforderungen
- Zulassung und Dokumentation
- Behörden, Institutionen und Verbänden
- Weitere Themen der Regulatory Affairs
1. Was Regulatory Affairs ist
Regulatory Affairs umfasst die Prozesse und Aktivitäten, die sicherstellen, dass Medizinprodukte die regulatorischen Anforderungen der Länder erfüllen, in denen sie verkauft werden sollen. Dazu gehören die
- Einholung der erforderlichen Genehmigungen und Freigaben von den Aufsichtsbehörden,
- Einhaltung der geltenden Vorschriften und Normen sowie
- Aufrechterhaltung der Konformität während des gesamten Produktlebenszyklus bis zur Außerbetriebnahme.
Zu den Aufgaben des Bereichs Regulatory Affairs gehört auch die Überwachung von Änderungen der Vorschriften und Normen und die Kommunikation dieser Änderungen mit den Interessengruppen innerhalb des Unternehmens, um eine kontinuierliche Einhaltung zu gewährleisten.
Damit spielt Regulatory Affairs eine entscheidende Rolle, wenn es darum geht, sicherzustellen, dass Medizinprodukte sicher und wirksam sind und den gesetzlichen Anforderungen entsprechen.
2. Regulatorische Anforderungen
a) Deutschland
b) Europa
c) USA
d) Andere Märkte
3. Zulassung und Dokumentation
a) Zulassung
Finden Sie weitere Informationen zur internationalen Zulassung.
b) Qualifizierung und Klassifizierungen (Wie ist mein Produkt einzuteilen?)
c) Technische Dokumentation (Was muss ich pro Produkt dokumentieren?)
d) Qualitätsmanagement (Was sollte Ihre Firma erfüllen?)
Das Qualitätsmanagement zählt üblicherweise nicht zur Verantwortung von Regulatory Affairs. Dennoch listen wir Ihnen einige wichtige Artikel.
4. Behörden, Institutionen und Verbände
a) Deutschland
| BfArM: Bundesamt für Arzneimittel und Medizinprodukte |
| DIMDI (Deutsches Institut für medizinische Informatik; wurde inzwischen in das BfArM integriert) |
| DAkkS, die deutsche Akkreditierungsstelle |
| Länderbehörden: Regierungspräsidien, Gewerbeaufsichtsämter, Regierungen |
b) Europa
c) International
| IMDRF: International Medical Device Regulators Forum |
5. Regulatory Affairs: Weitere Themen
Sie finden hier einen Artikel über die Aufgaben und Kompetenzen von Regulatory Affairs Manager.
Die Aufgaben von Regulatory Affairs umfassen auch das Finden und Beseitigen von Abweichungen und Nicht-Konformitäten. Die (notfallmäßige) Beseitigung nennt sich Remediation.
Beachten Sie die Vor- und Nachteile von Regulatory Information Management Systemen (RIMS) und deren Rolle bei der digitalen Transformation der Hersteller.
Ein Teil der Aufgaben von Regulatory Affairs ist die Regulatory Intelligence.
Wenn regulatorische Anforderungen nicht erfüllt sind, ist häufig eine Remediation erforderlich.
Benötigen Sie Unterstützung?
Haben Sie noch Fragen, beispielsweise zur Zulassung Ihrer Produkte? Dann nutzen Sie das kostenfreie Micro-Consulting.
Falls Sie Unterstützung dabei wünschen, Ihre Medizinprodukte gesetzeskonform zu entwickeln und „zuzulassen“, dann nehmen Sie gleich Kontakt auf. Das Team das Johner Instituts hilft gerne!
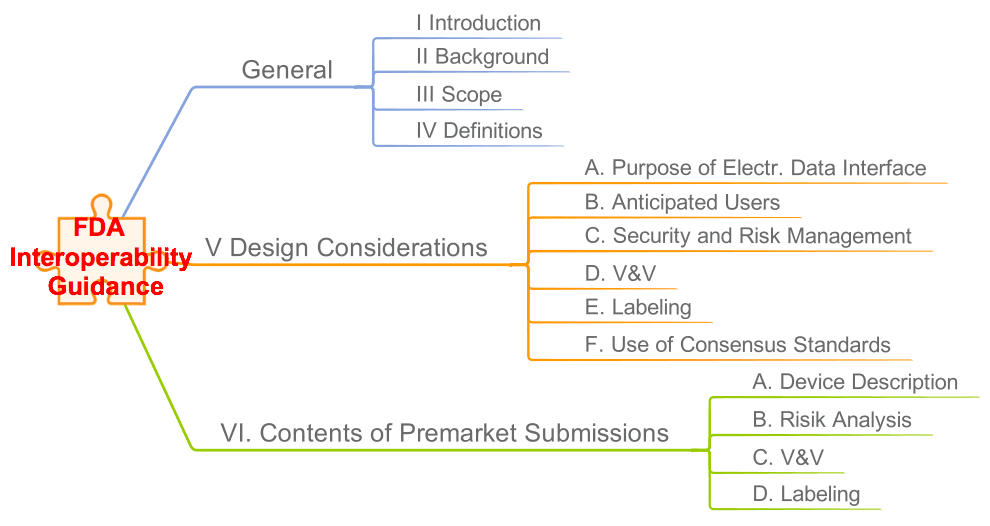
Die FDA hat ein Interoperability Guidance als Entwurf veröffentlicht. Es trägt den Titel „Design Considerations and Pre-market Submission Recommendations for Interoperable Medical Devices“ (hier zum Download). Lesen Sie hier, was die FDA damit bezweckt und auf welche Anforderungen Sie sich einstellen müssen.
Details
Die ISO 19011 kennen leider nur wenige Medizinproduktehersteller. Dabei gibt ihnen diese Norm konkrete Hinweise, wie man Audits systematisch plant, durchführt, dokumentiert und nachbereitet. Ihre benannten Stellen haben die ISO 19011 im Hinterkopf, wenn Sie bei Ihnen im ISO 13485-Zertifzierungsaudit prüfen, ob Sie interne Audits wirksam durchführen. Ein Grund mehr, diese ISO 19011 kennen zu…
Details
Die Medizinproduktebetreiber-Verordnung (MPBetreibV) fordert in §7 ein Medizinproduktebuch. Betrifft Sie das als Hersteller, wenn Sie für Ihre App Daten auf einem Server speichern? Betrifft das Ihre Kunden, wenn Ihr Medizinprodukt eine standalone Software ist? Finden Sie hier Antworten.
MDD gilt nicht mehr! Beachten Sie, dass die MDD mit dem 26.05.21 außer Kraft gesetzt und durch die Medizinprodukteverordnung (2017/745) – MDR abgelöst wurde. Unter „MDD Checkliste“ versteht man eine typischerweise tabellarische Auflistung, mit der Medizinprodukte-Hersteller aufzeigen, wie sie die grundlegenden Anforderungen der Richtlinien erfüllen. Inhaltsübersicht MDD Checkliste: Wirklich vorgeschrieben? » Aufbau und Format einer MDD…
Details
Die NBOG ist die Notified Body Operations Group. Diese Organisation legt Richtlinien fest, von denen Sie als Hersteller zumindest indirekt betroffen sind.
Details
Ein Review ist eine manuelle Bewertung eines Artefakts (z.B. Code, Dokument), das abhängig von den formalen Anforderungen und den beteiligten Personen beispielsweise als Inspektion oder Walk-through bezeichnet wird.
Die FDA MAUDE Datenbank stellt Informationen zur „Manufacturer and User Facility Device Experience“ bereit. Sie entspricht damit etwa der Datenbank, mit der das BfArM Meldungen von Hersteller zur Risiken publiziert. Inhaltsübersicht Inhalt der MAUDE Datenbank » Neues Werkzeug zur Auswertung » Regulatorischer Hintergrund »
Details
Unter der „Refuse to Accept Policy“ der FDA versteht man einen Kriterienkatalog, anhand dessen die FDA 510(k) Anträge bewertet und ggf. zurückweist. Diese „Refuse to Accept Policy“ hat die FDA im August 2015 aktualisiert.
Medizinprodukte-Sicherheitsbeauftragter: Diese Rolle wird im Medizinproduktegesetz gefordert, das jedoch seit Mai 2021 nur noch für Hersteller von IvD-Produkten gilt, jedoch nicht mehr für Hersteller von Medizinprodukten. Der Sicherheitsbeauftragte war eine „deutsche Erfindung“, die sich nicht direkt aus den europäischen Richtlinien wie der Medizinprodukterichtlinie ableiten ließ. Vorsicht! Die nun gültige Medizinprodukteverordnung (MDR) sieht mit der verantwortlichen…
Details
Wie sieht es mit der Haftung des einzelnen, des Managements und der ganzen Firma aus, werde ich immer wieder gefragt. Schließlich sieht der Gesetzgeber nicht nur im Medizinproduktegesetz Geld- und Freiheitsstrafen vor. Auch für die Entwicklungsdienstleister stellt sich die Frage nach der Haftung.