Der Bereich „Regulatory Affairs“ umfasst über 200 Aufgaben, die bei der Entwicklung und Zulassung von Medizinprodukten zu erledigen sind.
Sie finden hier eine Übersicht über die wichtigsten Inhalte, damit Sie Ihr Produkt schnell zulassen können.
Inhalt
Sie finden auf dieser Seite Fachartikel zu diesen Themen:
- Was Regulatory Affairs ist
- Regulatorische Anforderungen
- Zulassung und Dokumentation
- Behörden, Institutionen und Verbänden
- Weitere Themen der Regulatory Affairs
1. Was Regulatory Affairs ist
Regulatory Affairs umfasst die Prozesse und Aktivitäten, die sicherstellen, dass Medizinprodukte die regulatorischen Anforderungen der Länder erfüllen, in denen sie verkauft werden sollen. Dazu gehören die
- Einholung der erforderlichen Genehmigungen und Freigaben von den Aufsichtsbehörden,
- Einhaltung der geltenden Vorschriften und Normen sowie
- Aufrechterhaltung der Konformität während des gesamten Produktlebenszyklus bis zur Außerbetriebnahme.
Zu den Aufgaben des Bereichs Regulatory Affairs gehört auch die Überwachung von Änderungen der Vorschriften und Normen und die Kommunikation dieser Änderungen mit den Interessengruppen innerhalb des Unternehmens, um eine kontinuierliche Einhaltung zu gewährleisten.
Damit spielt Regulatory Affairs eine entscheidende Rolle, wenn es darum geht, sicherzustellen, dass Medizinprodukte sicher und wirksam sind und den gesetzlichen Anforderungen entsprechen.
2. Regulatorische Anforderungen
a) Deutschland
b) Europa
c) USA
d) Andere Märkte
3. Zulassung und Dokumentation
a) Zulassung
Finden Sie weitere Informationen zur internationalen Zulassung.
b) Qualifizierung und Klassifizierungen (Wie ist mein Produkt einzuteilen?)
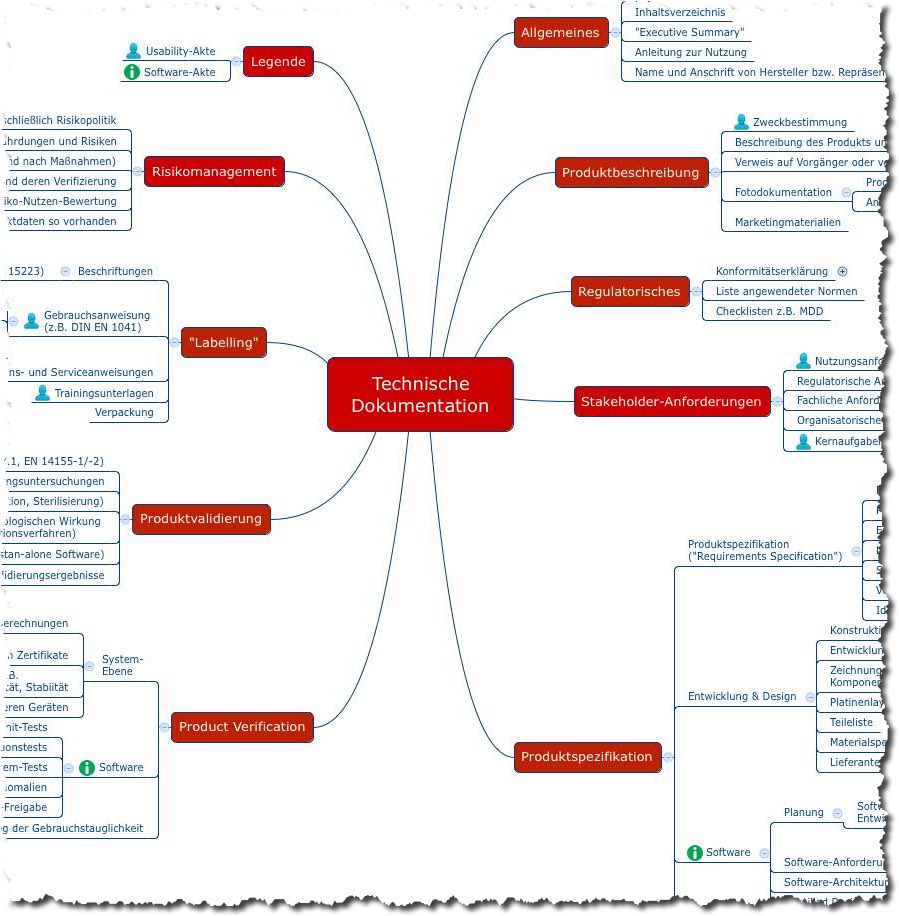
c) Technische Dokumentation (Was muss ich pro Produkt dokumentieren?)
d) Qualitätsmanagement (Was sollte Ihre Firma erfüllen?)
Das Qualitätsmanagement zählt üblicherweise nicht zur Verantwortung von Regulatory Affairs. Dennoch listen wir Ihnen einige wichtige Artikel.
4. Behörden, Institutionen und Verbände
a) Deutschland
| BfArM: Bundesamt für Arzneimittel und Medizinprodukte |
| DIMDI (Deutsches Institut für medizinische Informatik; wurde inzwischen in das BfArM integriert) |
| DAkkS, die deutsche Akkreditierungsstelle |
| Länderbehörden: Regierungspräsidien, Gewerbeaufsichtsämter, Regierungen |
b) Europa
c) International
| IMDRF: International Medical Device Regulators Forum |
5. Regulatory Affairs: Weitere Themen
Sie finden hier einen Artikel über die Aufgaben und Kompetenzen von Regulatory Affairs Manager.
Die Aufgaben von Regulatory Affairs umfassen auch das Finden und Beseitigen von Abweichungen und Nicht-Konformitäten. Die (notfallmäßige) Beseitigung nennt sich Remediation.
Beachten Sie die Vor- und Nachteile von Regulatory Information Management Systemen (RIMS) und deren Rolle bei der digitalen Transformation der Hersteller.
Ein Teil der Aufgaben von Regulatory Affairs ist die Regulatory Intelligence.
Wenn regulatorische Anforderungen nicht erfüllt sind, ist häufig eine Remediation erforderlich.
Benötigen Sie Unterstützung?
Haben Sie noch Fragen, beispielsweise zur Zulassung Ihrer Produkte? Dann nutzen Sie das kostenfreie Micro-Consulting.
Falls Sie Unterstützung dabei wünschen, Ihre Medizinprodukte gesetzeskonform zu entwickeln und „zuzulassen“, dann nehmen Sie gleich Kontakt auf. Das Team das Johner Instituts hilft gerne!
Ein ‚Request for Information‘ kann Ihnen teure Anwaltskosten (teilweise) ersparen. Fragen Sie die Behörde doch selbst! So kommen Sie zu einer qualifizierten Antwort. Wenn auch nicht kostenlos. Lesen Sie hier,
Details
Viele Änderungen der Medizinprodukteverordnung (MDR) betreffen alle Hersteller von Medizinprodukten. Einige dieser Änderungen wenden sich besonders an Hersteller, deren Produkte Software enthalten oder Standalone-Software sind. Lesen Sie, was diese Hersteller beachten sollten.
Die Vereinigten Arabischen Emirate (VAE) mit ihren „Hubs“ Dubai und Abu Dhabi sind eine der am weitesten entwickelten Volkswirtschaften des Nahen Ostens. Die Emirate zählen zu den reichsten Ländern der Welt. Das Gesundheitssystem gilt als hochentwickelt, weshalb die „United Arab Emirates“ (UAE) in der Region ein beliebtes Ziel des Gesundheitstourismus sind. Auch deshalb entwickeln sich…
Details
Die Anforderungen an klinische Prüfungen zur Bewertung eines Produkts sind unter der MDR enorm gestiegen. Erfahren Sie hier das Wichtigste, was es über den regulatorischen Weg der klinischen Prüfungen im Rahmen der MDR zu wissen gibt.
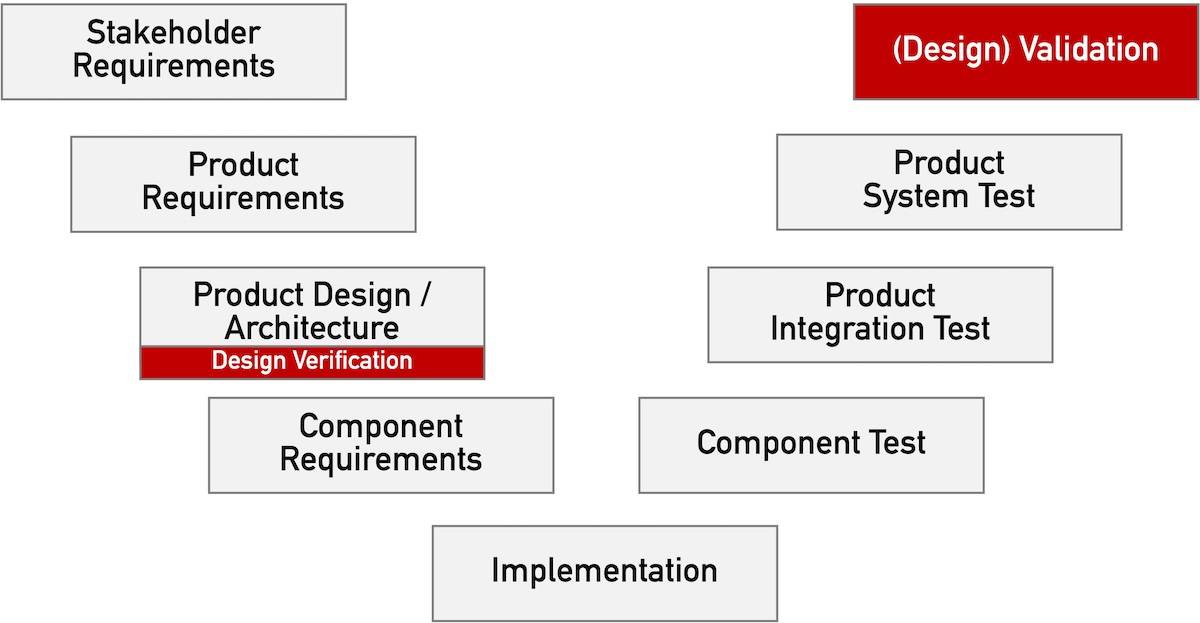
Den Begriff „Design Validation“ assoziieren die meisten Medizinproduktehersteller mit der FDA. Doch nicht nur die FDA, sondern auch die europäischen Regularien, insbesondere die ISO 13485, fordern eine Validierung von Design und Entwicklung. Dabei sollten allerdings „Design Validation“ und Validierung des Designs nicht verwechselt werden. Wie sich beide unterscheiden und welche regulatorischen Anforderungen zu beachten sind, zeigt…
Details
Das Medical Device Single Audit Program (MDSAP) wurde ins Leben gerufen, um einen Wunsch vieler Medizinproduktehersteller zu erfüllen: Statt vieler Audits und Inspektionen durch die Behörden verschiedener Länder soll es nur noch eines geben. Die Teilnahme am MDSAP soll ausreichen, um die Wirksamkeit und Konformität von QM-Systemen (z. B. Konformität mit ISO 13485 oder 21…
Details
Ist die STED (Summary Technical Documentation) und deren Nachfolger ToC (Table of Contents) die Lösung für Medizinproduktehersteller, die ihre Produkte international zulassen müssen? Dieser Beitrag stellt die STED bzw. ToC und vor damit einen Vorschlag, wie Hersteller die technische Dokumentation strukturieren können.
Details
Mit dem Pre-Submission-Programm (kurz „Pre-Sub“) bietet die FDA ein formales Verfahren an, mit dem Hersteller bereits vor der eigentlichen Zulassung ihre Zulassungsstrategie sowie konkrete Fragen klären können. Ein Pre-Sub Request eignet sich unter anderem im Vorfeld von 510(k)s, De Novo Requests oder auch PMAs. Damit können auf beiden Seiten unnötige Kosten und Aufwände vermieden werden. Das Johner…
Details
Mit dem eStar-Programm möchte die FDA die Effizienz von Zulassungsverfahren (z. B. der 510(k)-Verfahren) durch Digitalisierung erhöhen. Bei der Weiterentwicklung von eStar arbeitet das Johner Institut mit der FDA zusammen. Wie zukunftsweisend dieser Ansatz ist und ob Sie daran teilnehmen sollten oder gar müssen, erfahren Sie in diesem Artikel.
Details
Es ist nicht einfach, in Brasilien Medizinprodukte zuzulassen. Das liegt sowohl an der Anzahl und Komplexität der Regularien als auch an der Tatsache, dass Brasilien die meisten Regularien nur auf Portugiesisch veröffentlicht hat. Dieser Artikel verschafft Ihnen einen Überblick und stellt die Gemeinsamkeiten mit dem europäischen und dem US-amerikanischen System vor. So wird es Ihnen…
Details