Der Bereich „Regulatory Affairs“ umfasst über 200 Aufgaben, die bei der Entwicklung und Zulassung von Medizinprodukten zu erledigen sind.
Sie finden hier eine Übersicht über die wichtigsten Inhalte, damit Sie Ihr Produkt schnell zulassen können.
Inhalt
Sie finden auf dieser Seite Fachartikel zu diesen Themen:
- Was Regulatory Affairs ist
- Regulatorische Anforderungen
- Zulassung und Dokumentation
- Behörden, Institutionen und Verbänden
- Weitere Themen der Regulatory Affairs
1. Was Regulatory Affairs ist
Regulatory Affairs umfasst die Prozesse und Aktivitäten, die sicherstellen, dass Medizinprodukte die regulatorischen Anforderungen der Länder erfüllen, in denen sie verkauft werden sollen. Dazu gehören die
- Einholung der erforderlichen Genehmigungen und Freigaben von den Aufsichtsbehörden,
- Einhaltung der geltenden Vorschriften und Normen sowie
- Aufrechterhaltung der Konformität während des gesamten Produktlebenszyklus bis zur Außerbetriebnahme.
Zu den Aufgaben des Bereichs Regulatory Affairs gehört auch die Überwachung von Änderungen der Vorschriften und Normen und die Kommunikation dieser Änderungen mit den Interessengruppen innerhalb des Unternehmens, um eine kontinuierliche Einhaltung zu gewährleisten.
Damit spielt Regulatory Affairs eine entscheidende Rolle, wenn es darum geht, sicherzustellen, dass Medizinprodukte sicher und wirksam sind und den gesetzlichen Anforderungen entsprechen.
2. Regulatorische Anforderungen
a) Deutschland
b) Europa
c) USA
d) Andere Märkte
3. Zulassung und Dokumentation
a) Zulassung
Finden Sie weitere Informationen zur internationalen Zulassung.
b) Qualifizierung und Klassifizierungen (Wie ist mein Produkt einzuteilen?)
c) Technische Dokumentation (Was muss ich pro Produkt dokumentieren?)
d) Qualitätsmanagement (Was sollte Ihre Firma erfüllen?)
Das Qualitätsmanagement zählt üblicherweise nicht zur Verantwortung von Regulatory Affairs. Dennoch listen wir Ihnen einige wichtige Artikel.
4. Behörden, Institutionen und Verbände
a) Deutschland
| BfArM: Bundesamt für Arzneimittel und Medizinprodukte |
| DIMDI (Deutsches Institut für medizinische Informatik; wurde inzwischen in das BfArM integriert) |
| DAkkS, die deutsche Akkreditierungsstelle |
| Länderbehörden: Regierungspräsidien, Gewerbeaufsichtsämter, Regierungen |
b) Europa
c) International
| IMDRF: International Medical Device Regulators Forum |
5. Regulatory Affairs: Weitere Themen
Sie finden hier einen Artikel über die Aufgaben und Kompetenzen von Regulatory Affairs Manager.
Die Aufgaben von Regulatory Affairs umfassen auch das Finden und Beseitigen von Abweichungen und Nicht-Konformitäten. Die (notfallmäßige) Beseitigung nennt sich Remediation.
Beachten Sie die Vor- und Nachteile von Regulatory Information Management Systemen (RIMS) und deren Rolle bei der digitalen Transformation der Hersteller.
Ein Teil der Aufgaben von Regulatory Affairs ist die Regulatory Intelligence.
Wenn regulatorische Anforderungen nicht erfüllt sind, ist häufig eine Remediation erforderlich.
Benötigen Sie Unterstützung?
Haben Sie noch Fragen, beispielsweise zur Zulassung Ihrer Produkte? Dann nutzen Sie das kostenfreie Micro-Consulting.
Falls Sie Unterstützung dabei wünschen, Ihre Medizinprodukte gesetzeskonform zu entwickeln und „zuzulassen“, dann nehmen Sie gleich Kontakt auf. Das Team das Johner Instituts hilft gerne!
Die Norm ISO 15223-1 regelt die Symbole, die Hersteller zur Kennzeichnung von Medizinprodukten nutzen dürfen (bzw. müssen). Die EU-Kommission hat im Januar 2022 die EN ISO 15223-1 als einige von relativ wenigen Normen unter der MDR harmonisiert und in die Liste harmonisierter Normen aufgenommen. Das allein macht deutlich, wie relevant die Kennzeichnung mittlerweile geworden ist.…
Details
Die europäische Gesetzgebung definiert Systeme und Behandlungseinheiten („systems and procedure packs“) und unterscheidet verschiedene Konstellationen. Die regulatorischen Anforderungen an die Hersteller hängen stark von diesen Konstellationen ab. Lesen Sie in diesem Artikel, was die Gesetzgeber unter Systemen und Behandlungseinheiten verstehen, was die wichtigsten gesetzlichen Anforderungen an die Hersteller sind und welche typischen Fehler Sie vermeiden…
Details
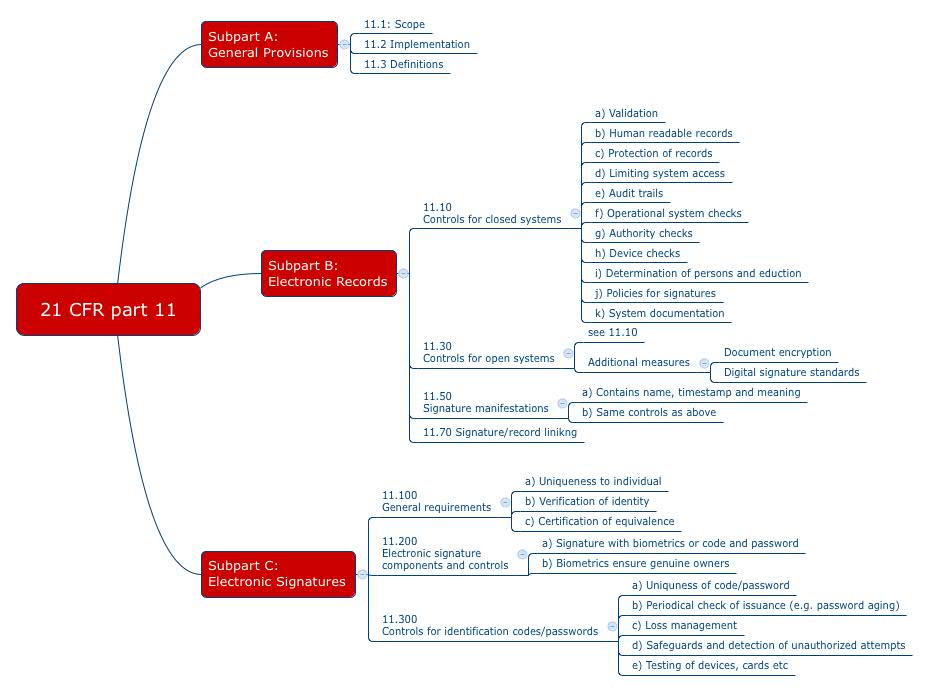
Mit dem 21 CFR Part 11 formuliert die FDA ihre Anforderungen an die elektronischen Aufzeichnungen und Unterschriften. Diese Anforderungen richten sich auch an Medizinproduktehersteller. Viele Firmen drucken Dokumente auf Papier aus und unterschreiben diese dann mit Hand, um die Anforderungen des „Part 11“ zu umgehen. Andere nutzen Signatur-Dienstleister. Doch ist das alles notwendig?
Details
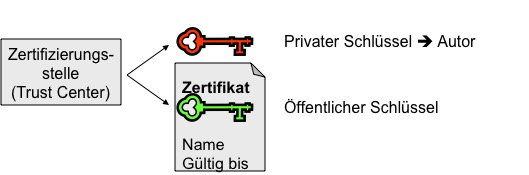
Elektronische Unterschriften und digitale Signaturen dürfen als gleichwertig zu handgeschriebenen Unterschriften („wet ink“) betrachtet werden. Welche Voraussetzungen dafür erfüllt sein müssen, hängt vom Grad der zu erreichenden Verbindlichkeit und damit vom Dokument ab, das unterschrieben werden soll. Dieser Artikel klärt,
Details
Den Begriff „Probenahme-Set“ definiert weder die IVDR noch eine andere Regularie. Dennoch gibt es (indirekte) regulatorische Anforderungen, die IVD-Hersteller und medizinische Labore kennen und beachten müssen. Die Anforderungen hängen von der jeweiligen Konstellation ab. Dieser Artikel stellt fünf Konstellationen vor. Er verschafft damit Klarheit und hilft, regulatorischen Ärger zu vermeiden und regulatorische Aufwände zu minimieren.
Details
„Gehen Sie nach dem PICO-Schema vor.“ So lautet die Empfehlung vieler Auditoren und Reviewer sowie einiger regulatorischer Dokumente (wie MDCG-Leitlinien und MEDDEV 2.7/1 rev.4), wenn es um präzise medizinische Literaturrecherchen geht. Lesen Sie in diesem Artikel,
Details
Klinische Studien in Australien durchzuführen, haben viele Medizinproduktehersteller nicht auf dem Schirm. Dabei gibt es gute Gründe, für klinische Studien bzw. klinische Prüfungen auch diesen Kontinent in Betracht zu ziehen. Hersteller sollten dann aber auch die regulatorischen Anforderungen Australiens und spezifische Nachteile kennen.
Abweichungen, Nichtkonformitäten, Fehler, Findings und weitere Begriffe werden fälschlicherweise oft synonym verwendet. Sogar Normen widersprechen sich bei der Definition einzelner Begriffe explizit. Dieser Artikel klärt,
Details
So stellen Sie sicher, dass Sie Ihre Inhouse-IVD (auch Laboratory Developed Tests, LDT genannt) auch unter der nun gültigen IVDR noch anbieten können. Sie haben drei Möglichkeiten, um Rechtsstreitigkeiten zu vermeiden. Inhouse-IVD zählen zu den in-vitro-diagnostischen Tests. Gelten für diese Art von Produkten auch regulatorische Anforderungen wie die IVDR? Dieser Artikel verschafft nicht nur medizinischen…
Details
Die ISO 27001 und die Informationssicherheitsmanagementsysteme (ISMS) werden bei Medizinprodukteherstellern immer häufiger zum Thema. Die Regularien geben dazu Anlass. Dazu zählt u. a. die Digitale-Gesundheitsanwendungen-Verordnung (DiGAV), die die ISO 27001 in den Fokus vieler Medizinproduktehersteller gerückt hat. Hersteller müssen die regulatorischen Anforderungen erfüllen, um Ärger mit Behörden und Benannten Stellen zu vermeiden und um Patienten…
Details