QM Dokumentenlenkung: Wie viele im Audit scheitern
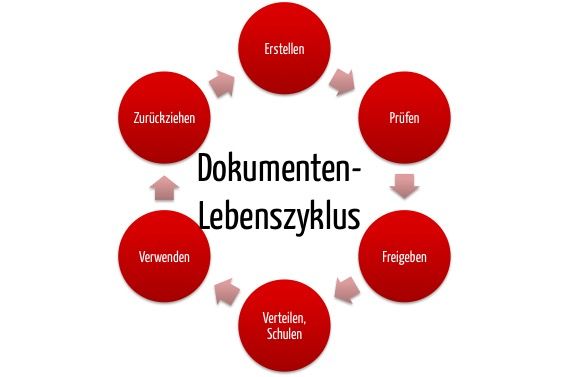
Unter Dokumentenlenkung versteht man ein dokumentiertes Verfahren, das festlegt, wie Dokumente erstellt, geprüft, genehmigt, gekennzeichnet, verteilt und aktualisiert werden. Nach ISO 9001 oder ISO 13485 zertifizierte Organisationen sind zur Dokumentenlenkung verpflichtet.
Details