AQL (Acceptable Quality Level) – Wann ist gut gut genug?
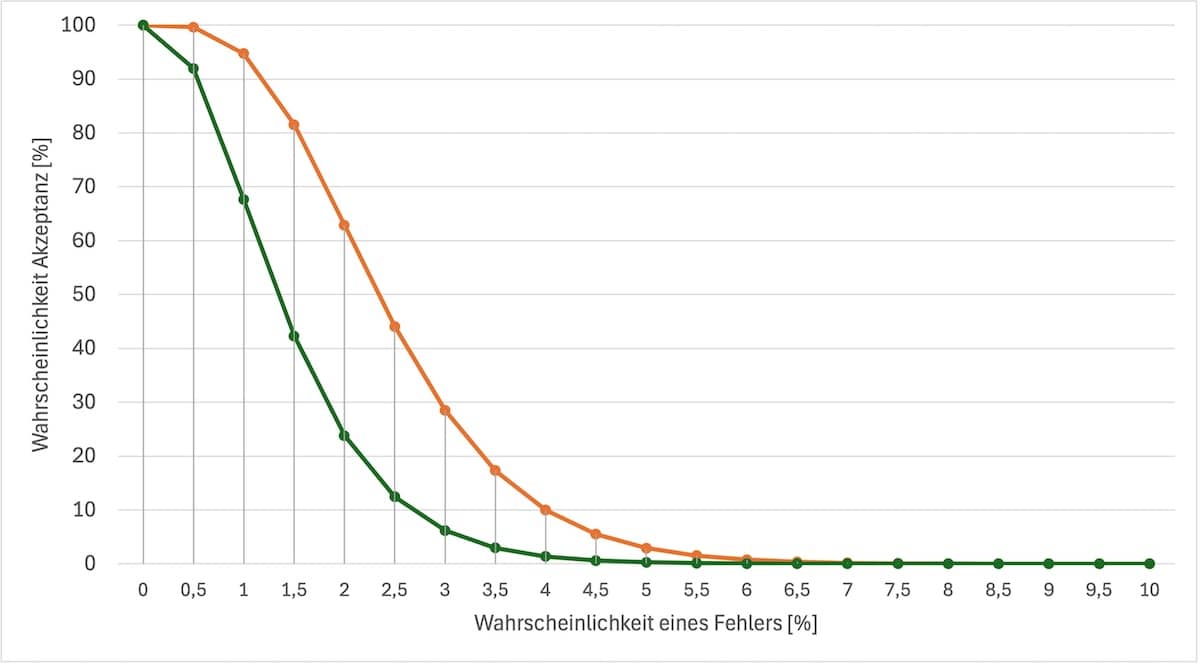
AQL steht für Acceptable Quality Level und wird manchmal mit „erlaubte Ausschussquote“ übersetzt. Das AQL bestimmt, wann ein Los an Teilen oder Produkten auf Basis einer Stichprobenprüfung zurückgewiesen bzw. akzeptiert wird. Doch regelmäßig akzeptieren Auditoren das AQL nicht mehr. Was tun? Dieser Artikel gibt Antworten. 1. Wen das Thema „AQL“ wann betrifft 1.1 Betroffene Rollen…
Details