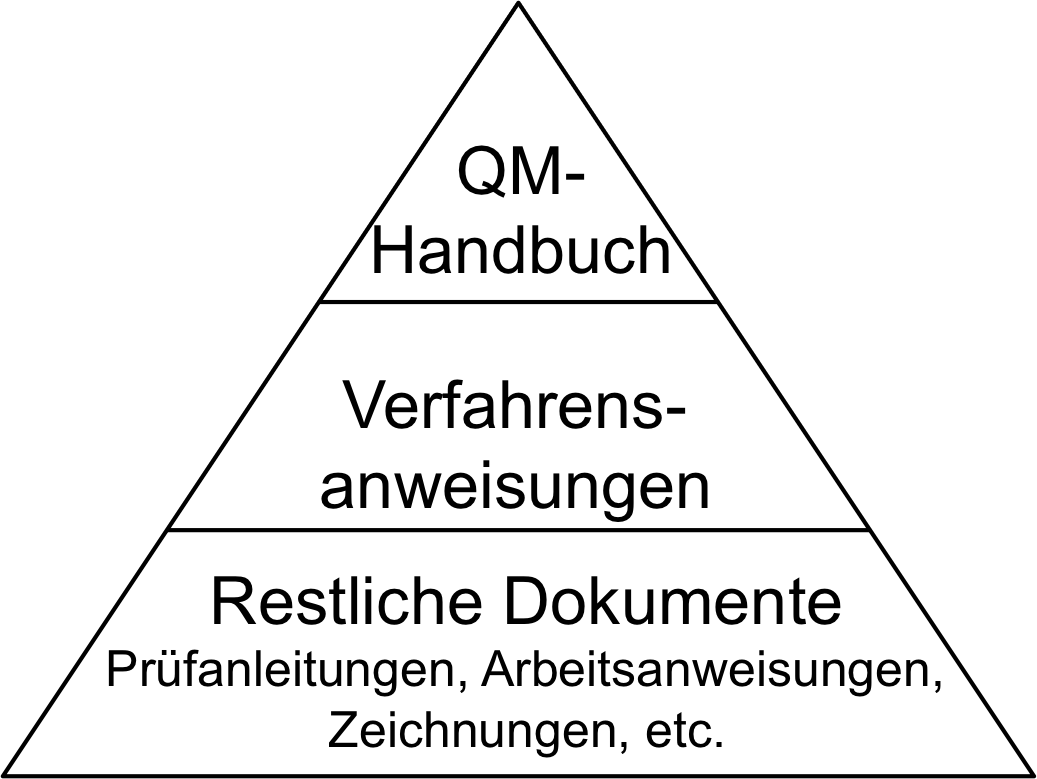
QM-Handbuch: Inhalt und Aufbau
Das QM-Handbuch stellt in der Dokumentenpyramide des QM-Systems das oberste Dokument dar. Es dient als Einstiegspunkt für Mitarbeiter und Auditoren, um einen schnellen Überblick über das QM-System zu verschaffen. Erfahren Sie in diesem Beitrag, wann Sie ein QM-Handbuch benötigen, welche Ziele es verfolgt und welche Inhalte es enthalten sollte.
Details