Accessibility – Barrierefreiheit
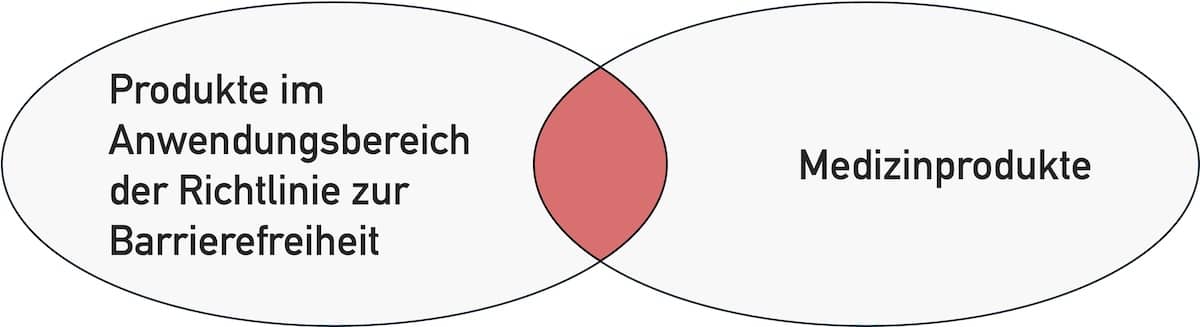
Unter der Barrierefreiheit – auf Englisch Accessibility – versteht man die Gestaltung von Angeboten, die auch von Menschen mit körperlichen Einschränkungen genutzt werden können. Der Begriff ‚Angebote‘ umfasst Bauwerke ebenso wie digitale und nichtdigitale Produkte. Das schließt auch Medizinprodukte (Geräte, App, Standalone-Software) ein. Welche Anforderungen an die Accessibility Hersteller von Medizinprodukten beachten sollten, um der…
Details