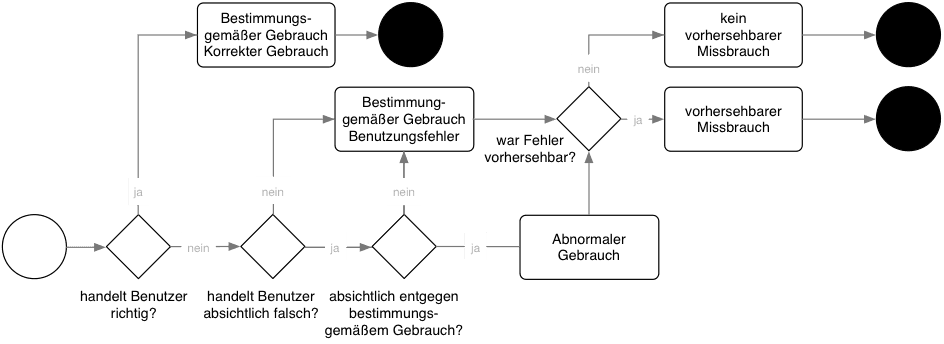
Legacy Software: Forderungen der IEC 62304
Legacy Software definiert die IEC 62304 in deren neuen Ammendment I als Software (Teil eines Medizinprodukts oder eigenständige Software), die zum damaligen Zeitpunkt legal in Verkehr gebracht wurde, aber heutigen Anforderungen (insbesondere der IEC 62304) nicht mehr genügt. Update: Abgrenzung von Legacy Software, SOUP und OTS
Details