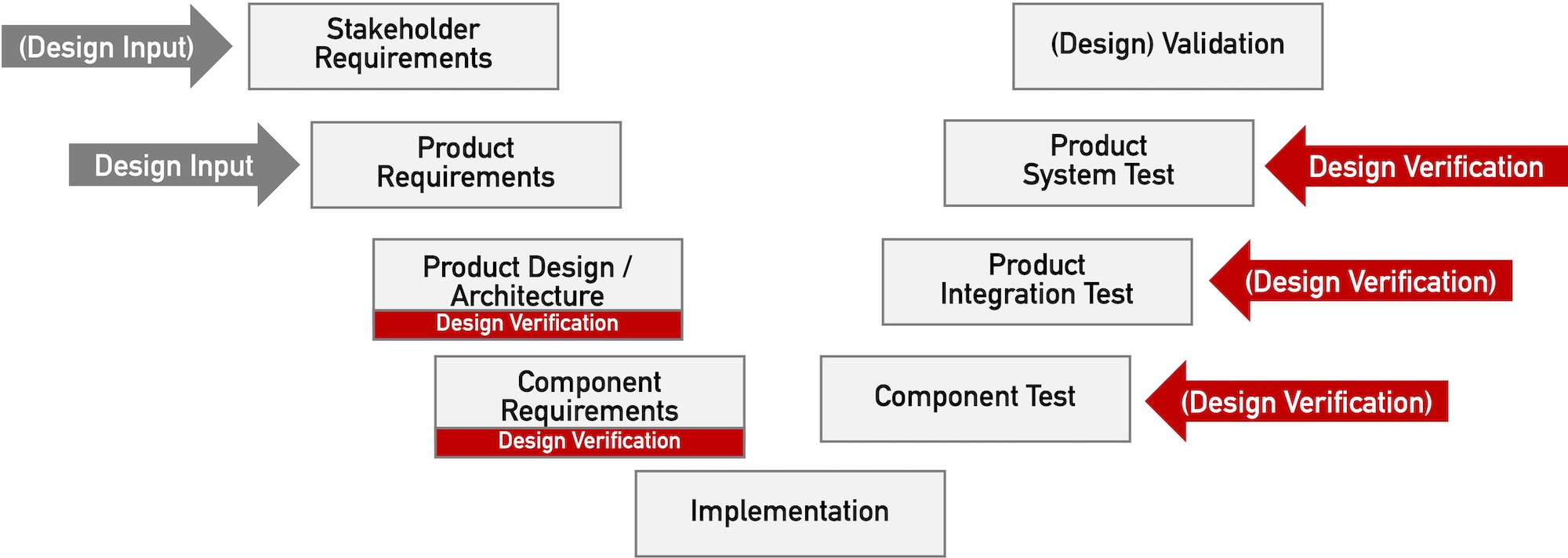
Closed-Loop-Systeme bei Medizinprodukten
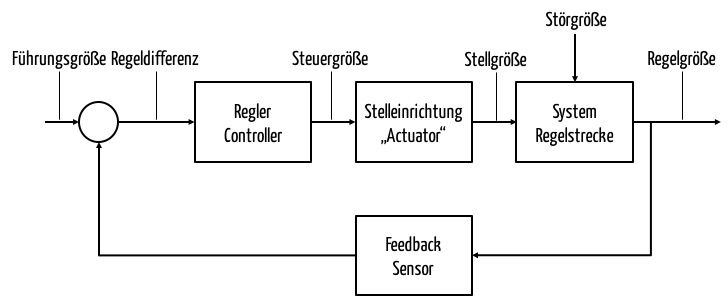
Medizinprodukte basieren zunehmend auf Closed-Loop-Systemen. Diese „geschlossenen Regelsysteme“ finden bereits in der Medizinprodukteverordnung MDR Erwähnung. Ein Beispiel ist ein System aus einer Insulinpumpe, die von einem Gerät mit Glukosesensor gesteuert wird. Sie erfahren in diesem Artikel, was Closed-Loop-Systeme sind, wo sie in der Medizin zum Einsatz kommen und welche regulatorischen Anforderungen sie erfüllen müssen. Der…
Details