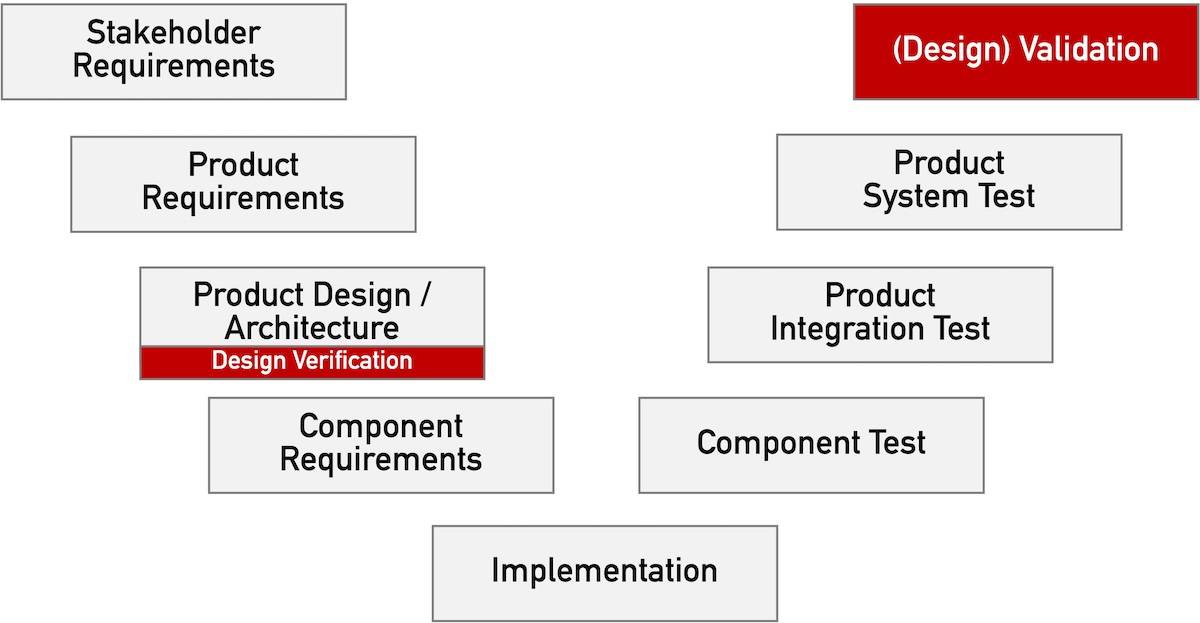
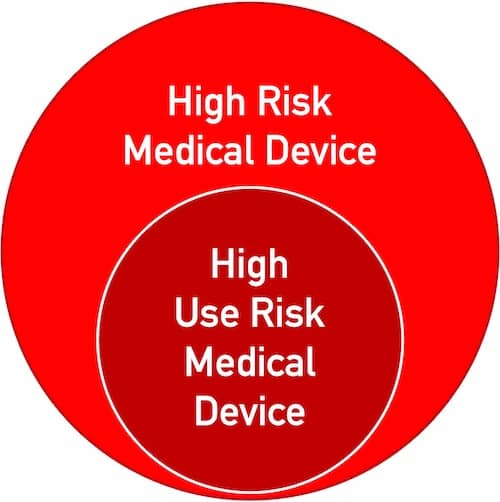
MDR: Software-Hersteller aufgepasst!
Viele Änderungen der Medizinprodukteverordnung (MDR) betreffen alle Hersteller von Medizinprodukten. Einige dieser Änderungen wenden sich besonders an Hersteller, deren Produkte Software enthalten oder Standalone-Software sind. Lesen Sie, was diese Hersteller beachten sollten.